
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Оксиди Основи Кислоти Солі
 | |||||||||
 | |||||||||
 |  |  | |||||||
 - основні; - одно - безоксигенвмісні; - середні;
- основні; - одно - безоксигенвмісні; - середні;
- кислотні; -дву -оксигенвмісні - кислі;
- амфотерні - трикислотні - основні;
- подвійні;
- змішані
Численні сполуки, що їх утворюють хімічні елементи, характеризуються різноманітністю за складом та властивостями. Серед них найбільшу і найважливішу групу становлять неорганічні сполуки, властивості яких вивчаються студентами вищих навчальних закладів у курсах "Неорганічна хімія" та "Загальна хімія".
До найважливіших класів неорганічних сполук належать бінарні сполуки елементів з киснем (оксиди, пероксиди, надпероксиди, озоніди), основи, кислоти, амфотерні гідроксиди та солі. У підручниках та навчальних посібниках з хімії для вищих навчальних закладів тему "Найважливіші класи неорганічних сполук" висвітлено недостатньо. Між тим, знання хімічних властивостей речовин, які вступають у реакцію, дає можливість передбачити перебіг тієї чи іншої реакції, свідомо складати хімічні рівняння та робити кількісні розрахунки. Все це конче необхідне студентам для подальшого вивчення хімії.
Загалом відомо біля трьохсот тисяч неорганічних сполук. Серед них можна виділити чотири найважливіші класи: оксиди, основи, кислоти, солі. Знаючи особливості основних класів неорганічних сполук, можна описати властивості окремих їх представників.
Оксиди являють собою складні речовини, молекули яких складаються з атомів кисню та іншого хімічного елемента (металу або неметалу). Наприклад: оксиди літію – (Li2O), ферум (II) – FeO, хрому (III) – Cr2O3, силіцій диоксид – (SiO2), фосфорний ангідрид (Р2O5).
Оксиди поділяються на солетворні та несолетворні. Останні не здатні утворювати солей ні з кислотами, ні з лугами, їх зовсім мало (крабон монооксид СО, нітроген монооксид NO, нітроген геміоксид N2O). Солетворні оксиди поділяються на основні (їх гідрати являються основами), кислотні (їх гідрати являють собою кислоти) та амфотерні (їх гідрати проявляють як кислотні, так і основні властивості).
За сучасною хімічною номенклатурою представники цього класу сполук називаються наступним чином: до слова "оксид" добавляється назва іншого елемента з посиланням на ступінь окиснення, якщо він змінний.
Наприклад: СаО – кальцій оксид, Fe2O3 – ферум (III) оксид, Р2О5 – фосфор (V) оксид.
До основних оксидів відносяться переважно оксиди лужних та лужноземельних металів з яскраво вираженими металічними властивостями. Характерною рисою основних оксидів являється їх взаємодія з водою, що веде до утворення основ.
ВаО + Н2O = Ва(ОH)2
Причому, безпосередньо з водою при звичайній температурі реагують тільки оксиди s-елементів головних підгруп періодичної системи Д.І. Менделєєва (окрім оксидів берилію та магнію).
Основні оксиди взаємодіють з кислотними оксидами та кислотами, утворюючи солі:
СаО + СO2 = СаСO3
СuО + 2НСl = СuС12 + Н2O
Кислотні оксиди утворюються неметалами (нітратний ангідрид N2O5), сульфатний ангідрид SO3, хлорний ангідрид Сl2O7 та інші), а також металами, що проявляють ступені окиснення +5, +8, +7 (ванадій оксид (V) V2O5, хром триоксид СrO3, марганцевий ангідрид Мn2O7, вольфрам триоксид WO3). Більшість з кислотних оксидів безпосередньо взаємодіють з водою з утворенням відповідних кислот, являючись, таким чином, їх ангідридами:
SO2 + Н2О = Н2SO3
СrO3 + Н2О = Н2СrO4
Взаємодіючи з лугами, кислотні оксиди утворюють відповідні солі з виділенням води:
СO2 + 2NaОН = Na2СО3 + Н2O
Амфотерні оксиди утворюються деякими металами, що проявляють ступені окиснення +3, +4, іноді навіть +2. Так, наприклад, до амфотерних оксидів відносяться оксиди берилію ВеО, цинку ZnО та алюмінію Аl2O3, оксид хрому (III) Сr2O3, оксиди олова SnО і свинцю РbО (II), манган диоксид МnO2 та деякі інші. Вони характеризуються реакціями солетворення як з кислотами, так і з основами, тому що в залежності від реагентів, з якими вони взаємодіють, здатні проявляти як основні, так і кислотні властивості.
Так хром (III) оксид реагує з кислотою як основний:
Сr2O3 + 6НСl = 2СrСl3 + 3Н2O,
а з лугами – як кислотний оксид:
Сr2O3 + 2NaОН = 2NaСrO2 + Н2O
Якщо елемент здатний утворювати декілька оксидів, наприклад, оксиди хрому (II, III, VI), то в напрямку збільшення ступеня окиснення металу відбувається закономірний перехід від основного, характеру відповідних сполук, що утворюють катіонні комплекси, до кислотних характеристик сполук, які утворюють аніонні комплекси. Так хром (III) оксид має амфотерний характер, хром (VI) оксид є хромовим ангідридом.
Оксиди можна отримати такими способами:
1. Взаємодією простих речовин з киснем:
2Мg + O2 = 2МgO
2Р + 5O2 = 2Р2O5
2. Термічним розкладом складних речовин:
Сu(ОН)2 = СuО + Н2O
СаСO3 =СаО + СO2
2Zn(NO3)2 = 2ZnО + 4NO2 + O2
3. Взаємодією металів з кислотами:
Сu + 4HNO3 = Сu(NO3)2 + 2NO2 + 2Н2O
концентрований розчин
3Сu + 8HNO3 = 3Сu(NO3)2 + 2NO2 + 4Н2O
розведений розчин
4. В ході інших окисно-відновних реакцій:
СO2 +С = 2СО
2СО + O2 = 2СO2
Основи становлять собою електроліти, які при дисоціації утворюють в якості аніонів тільки гідроксиданіони:
NаОН = Na+ + ОН–
Кислотність основи визначається числом гідроксид-аніонів, які утворюються при дисоціації. Багатокислотні основи дисоціюють ступенево у кілька стадій:
1) Мg(ОН)2 = (МgОН)+ + ОН–
2) (МgОН)+ = Мg2+ + ОН–
За розчинністю у воді основи розрізняються таким чином:
а) луги – це основи, що розчиняються у воді. До них можна віднести гідроксиди лужних та лужноземельних металів, а також талій (І) гідроксид;
б) нерозчинні основи: гідроксиди міді та цинку, хром (III) гідроксид.
Назви основ утворюються із слова "гідроксид" і назви відповідного металу з посиланням на його ступінь окиснення, якщо він змінний. Наприклад, Са(ОН)2 – кальцій гідроксид.
З точки зору теорії електролітичної дисоціації загальні властивості лугів обумовлені наявністю гідроксид-аніонів.
Водні розчини лугів змінюють забарвлення індикаторів: в їх присутності фіолетовий лакмус синіє, безбарвний фенолфталеїн стає малиновим, метиловий оранжевий – жовтіє.
Луги утворюють з кислотними оксидами солі та воду:
Ва(ОН)2 + СO2 = ВаСO3 + Н2О
Луги також взаємодіють з кислотами, утворюючи при цьому солі та воду. Це являє собою суть реакції нейтралізації:
NaОН + Н2SO4 = NaHSO4 + Н2O
2NaОН + Н2SO4 = Na2SO4 + 2Н2O
Fe(ОН)3 + 3НСl = FеСl3 + 3Н2O
При дії лугів на розчини солей утворюються нові солі і інші основи:
2KОН + СuSO4 = Сu(ОН)2 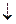 + К2SO4
+ К2SO4
Са(ОН)2 + Na2СO3 = СаСO3 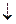 + 2NaОН
+ 2NaОН
Як правило, нерозчинні у воді основи розкладаються при нагріванні:
2Fe(ОН)3 = Fе2O3 + 3Н2O
Сu(ОН)2 = СuО + Н2O
Луги можна отримати таким чином:
1. Розчиненням у воді деяких відповідних оксидів:
СаО + Н2O = Са(ОН)2
2. Взаємодією з водою лужних та лужноземельних металів:
СаО + Н2O = Са(ОН)2
Поширеним способом отримання нерозчинних у воді основ є дія лугів на розчинні солі металів, основи яких нерозчинні:
2NаОН + FеSO4 = Fе(ОН)2 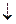 + Na2SO4
+ Na2SO4
Кислоти це електроліти, при дисоціації яких у якості катіонів утворюються тільки катіони гідрогену H+ (точніше, іони гідроксонію Н3O+):
HCl = H+ + Cl–
Основність кислот визначається числом катіонів гідрогену, які утворюються при дисоціації. Багатоосновні кислоти дисоціюють ступенево.
Наприклад:
Н2СO3 = Н+ + НСО3–
НСO3 = Н+ + СО32–
Кислоти можна віднести до безкисневих (хлоридна, бромидна, синильна, сірководнева) та кисневмісних (азотна, сірчана, фосфорні кислоти).
Читайте також:
- R – розрахунковий опір грунту основи, це такий тиск, при якому глибина зон пластичних деформацій (t) рівна 1/4b.
- Активне управління інвестиційним портфелем - теоретичні основи.
- Анатомо-фізіологічні основи статевого розвитку.
- Білки – це високомолекулярні органічні біополімери, мономерами яких є амінокислоти.
- Біологічні основи мислительної діяльності.
- Біомеханічні основи шинування при пародонтозі.
- Біохімічні основи розвитку витривалості
- Біохімічні основи розвитку силових і швидкісних якостей
- Валютний ринок, основи його функціонування. Основні види валютних операцій
- Вивчення основи слова і закінчення
- Вимоги до гірських порід основи гребель
- Виникнення права на позов і правові основи його реалізації
| <== попередня сторінка | | | наступна сторінка ==> |
| Класифікація класів неорганічних сполук | | | Властивості кислот |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |