
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тема. Визначення азоту аміаку, нітритів, нітратів і хлоридів
Приготування водної витяжки з ґрунту. Внаслідок біохімічних процесів самоочищення ґрунту органічні речовини, що потрапили в нього, поступово розкладаються, а потім перетворюються на мінеральні солі. Більша частина мінеральних солей, що утворюються у ґрунті під час мінералізації, розчиняється у воді, тому для визначення готують водну витяжку з ґрунту. Приготування водної витяжки залежить не лише від того, які речовини слід визначити, але й від ступеня здрібнювання ґрунту, температури, часу устоювання, співвідношення маси ґрунту й води.
Для визначення азоту аміаку, нітритів, нітратів і хлоридів, а також окисності водну витяжку готують у день проведення аналізів, змішуючи наважку ґрунту (50-100 г) з п'ятикратним об'ємом дистильованої води. Суміш збовтують 3-5 хв і фільтрують декілька разів через щільний фільтр. Якщо проведення аналізів переноситься на більш пізній строк, то приготовану витяжку консервують додаванням 0,2 г оксиду ртуті і зберігають у темному місці в закритому посуді.
Визначення окисності водної витяжки. Окисність ґрунту визначається кількістю кисню, витраченого на окислення органічних речовин водної витяжки зі 100 г ґрунту. Метод визначення окисності ґрунтується на здатності марганцевокислого калію виділяти у кислому середовищі в присутності органічних речовин атомарний кисень, що витрачається на їх окислення.
У колбу місткістю 250 мл наливають 10 мл водної витяжки, що відповідає 2 г ґрунту, доливають 90 мл дистильованої води. До отриманих 100 мл вихідного розчину додають піпеткою 5 мл 25% розчину сірчаної кислоти, із бюретки - 10 мл 0,01 н. розчину марганцевокислого калію. Рідину нагрівають і кип'ятять 10 хв (від часу закипання). Знявши колбу з вогню, в гарячий розчин доливають із бюретки 10 мл 0,01 н. розчину щавлевої кислоти. Знебарвлену рідину титрують марганцевокислим калієм до появи блідо-рожевого забарвлення. Підраховують об'єм розчину КMnO4, долитого в колбу до і після кип'ятіння (V1).
Для визначення поправкового коефіцієнта в колбу з відтитрованою до блідо-рожевого кольору рідиною знову доливають 10 мл 0,01 н. щавлевої кислоти і титрують марганцевокислим калієм до появи такого ж забарвлення. Отримують об'єм 0,01 н. розчину КМnO4 (мл), витрачений на титрування 10 мл 0,01 н. розчину щавлевої кислоти. Поправковий коефіцієнт К обчислюють за формулою
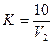
Виходячи з того, що 1 мл 0,01 н. розчину КМnO4 виділяє 0,08 мг кисню, а 1 мл 0,01 н. розчину С2Н2O4 потребує на окислення 0,08 мг кисню, знаходять окисність у міліграмах кисню, який пішов на окислення органічних речовин, що містяться у 10 мл водної витяжки з 2 г ґрунту:
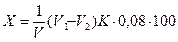 ,
,
де V1 - загальний об'єм 0,01 н. розчину КМnO4, що пішов на окислення 100 мл вихідного розчину і на 10 мл 0,01 н. розчину С2Н2O4, мл;
V2 - об'єм 0,01 н. розчину КМnO4, витраченого на окислення 10 мл 0,01 н. розчину С2Н2O4, мл;
К - поправковий коефіцієнт 0,01 н. розчину КМnO4;
0,08 - кількість кисню, який виділився з 0,01 н. розчину КМnO4 при нагріванні, мг;
V - кількість аналізованого ґрунту (2г).
Отримане значення необхідно помножити на 50, щоб одержати окисність 100 г ґрунту.
Визначення хлоридів у водній витяжці. Хлористі солі у вигляді хлористого натрію у водній витяжці з ґрунту осаджуються титрованим розчином азотнокислого срібла в присутності індикатора хромовокислого калію, який після осадження сріблом усіх хлоридів вступає в реакцію з азотнокислим сріблом, змінюючи забарвлення із зеленкувато-жовтого на цеглясто-червоне внаслідок утворення хромовокислого срібла:
NaCl + AgNO3 = AgCl + NaNO3;
2AgNO3 + K2CrO4 = Ag2CrO4 + 2KNO3.
За кількістю витраченого на осадження хлористих солей азотнокислого срібла обчислюють вміст хлоридів у водній витяжці.
У колбу місткістю 200 мл наливають 50 мл водної витяжки з ґрунту, додають 10 крапель хромовокислого калію і титрують розчином азотнокислого срібла до появи цеглясто-червоного забарвлення. Оскільки в 50 мл водної витяжки містяться хлориди із 10 г ґрунту, то для визначення кількості хлоридів у 100 г ґрунту кількість азотнокислого срібла, витрачену на титрування водної витяжки з 10 г ґрунту, множать на 10.
Визначення аміаку у водній витяжці ґрунту. Принцип визначення азоту аміачних сполук ґрунтується на їх здатності утворювати забарвлені сполуки з реактивом Несслера, який являє собою подвійну сіль йодистої ртуті та йодистого калію, розчинених у їдкому калі. Цей реактив із аміаком дає жовте забарвлення внаслідок утворення йодистого меркурамонію за реакцією
NH3 + [2(HgJ2·2KJ) + 3 KOH] = NH2Hg2JO + 7KJ + 2H2O.
Для якісного визначення аміаку у пробірку наливають 5 мл досліджуваної водної витяжки, додають 5-6 крапель реактиву Несслера, збовтують, залишають на 5 хв і, розглядаючи вміст пробірки зверху вниз на білому тлі, спостерігають появу жовтого забарвлення. Відсутність забарвлення свідчить про відсутність аміаку.
Для визначення вмісту аміаку в ґрунті в один циліндр Геннера наливають 100 мл досліджуваної водної витяжки, а в інший — 1 мл розчину хлористого амонію, який містить 0,01 мг аміачного азоту, а потім — 100 мл безаміачної дистильованої води. Вміст останнього циліндра ретельно перемішують скляною паличкою. Після цього в обидва циліндри додають по 2 мл 50% розчину сегнетової солі, потім — по 2 мл реактиву Несслера. Вміст обидвох циліндрів перемішують і-через 10 хв розглядають зверху вниз на білому тлі. Якщо в одному з них забарвлення інтенсивніше, обережно відливаючи частину вмісту, досягають однакового забарвлення в обидвох циліндрах.
Вміст азоту амонійних солей (мг/л) в досліджуваній водній витяжці з ґрунту визначають за формулою
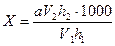
де а - вміст азоту в розчині хлористого амонію, мг/мл;
V1 - об'єм водної витяжки, взятої для визначення, мл (100 мл);
V2 - об'єм розчину хлористого амонію, взятого для приготування еталонного розчину, мл;
h1, - висота стовпчика рідини у циліндрі з досліджуваною пробою, см;
h2 - висота стовпчика рідини в циліндрі з еталонним розчином, см.
Визначення солей азотистої кислоти (нітритів). Якісну пробу та кількісне визначення здійснюють за допомогою реактиву Грісса, який утворює з азотистою кислотою сполуку рожевого кольору. Реактив Грісса складається з нафтиламіну і сульфанілової кислоти, розчинених в оцтовій кислоті, які реагують із азотистою кислотою за рівнянням
C10H7NH2 + NH2C6H4SO3H + HNO3 = NH2 – C10H6 – N = N – C6H4SO3H + 2H2S
Для якісного визначення нітритів до 10 мл досліджуваної витяжки додають 5-6 крапель реактиву Грісса, добре перемішують і залишають на 5-7 хв. Поява рожевого забарвлення свідчить про наявність нітритів, при відсутності останніх колір вмісту, пробірки не змінюється.
Для кількісного визначення нітритів в одну колбу наливають 100 мл водної витяжки, в іншу - 1-10 мл (залежно від кількості нітритів) стандартного розчину азотистого натрію, що містить в 1 мл 0,01 мг азоту, і до 100 мл додають дистильованої води. В обидві колби доливають по 5 мл реактиву Грісса і обережно нагрівають на водяній бані при температурі 50-60°С упродовж 10 хв. Вміст колб переносять у циліндри Геннера і здійснюють колориметрування, відливаючи частину вмісту з одного циліндра, в якому забарвлення інтенсивніше, до однакового забарвлення в обидвох циліндрах. Вміст азоту нітритів у досліджуваній пробі (мг / л) визначають за формулою
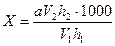 ,
,
де а - вміст азоту нітритів у розчині, взятому для приготування еталонного розчину мг/мл;
h1 - висота стовпчика рідини в циліндрі з досліджуваною пробою, см;
h2 - висота рідини в циліндрі з еталонним розчином, см;
V1 - об'єм водної витяжки, мл;
V2 - об'єм розчину, взятого для приготування еталонного розчину, мл.
Визначення солей азотної кислоти (нітратів). Наявність у водній витяжці з ґрунту азотнокислих сполук свідчить про те, що азотововмісні речовини повністю мінералізувалися.
Для якісного визначення нітратів у пробірку наливають 1 мл водної витяжки, додають кристалик бруцину й 2 мл концентрованої сірчаної кислоти. Якщо у водній витяжці присутній азот нітратів, з'являється рожеве забарвлення, яке згодом перетворюється на жовте.
При кількісному визначенні азоту нітратів у водній витяжці з ґрунту в порцелянову чашку наливають 100 мл витяжки і випарюють насухо на водяній бані. Дають чашці охолонути, а потім додають 1 мл дифеніл сульфокислоти й ретельно розтирають з осадом. Через 10 хв у чашку додають 10 мл дистильованої води і 3 мл їдкого калі. При наявності нітратів утворюється жовте забарвлення, яке порівнюють у циліндрах Геннера із забарвленням розчину нітрату калію. Для цього вміст порцелянової чашки переносять у циліндр Геннера й доводять дистильованою водою до 100 мл.
Вміст азоту нітратів у досліджуваній витяжці (мг/л) знаходять за формулою
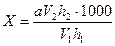 ,
,
де а - вміст азоту нітратів у розчині азотнокислого калію, мг/мл;
h1 - висота стовпчика рідини в циліндрі Геннера з водною витяжкою, см;
h2- висота стовпчика рідини в циліндрі Геннера з еталонним розчином нітрату калію, см;
V1 - об'єм досліджуваної витяжки, мл;
V2 - об'єм розчину азотнокислого калію, взятого для приготування еталонного розчину, мл.
За даними Фодора, в 100 г незабрудненого ґрунту міститься 6,8 мг загального азоту, 5,7 мг аміаку та 12,6 мг азотної кислоти.
Читайте також:
- CMM. Визначення моделі зрілості.
- I визначення впливу окремих факторів
- II. Визначення мети запровадження конкретної ВЕЗ з урахуванням її виду.
- II. Мотивація навчальної діяльності. Визначення теми і мети уроку
- Ocнoвнi визначення здоров'я
- S Визначення оптимального темпу роботи з урахуванням динаміки наростання втоми.
- Агроценоз як система.
- Азотування
- Алгебраїчний спосіб визначення точки беззбитковості
- Алгоритм побудови калібрувального графіка для визначення загального білка сироватки крові
- Алгоритм побудови калібрувального графіка для визначення загального білка сироватки крові
- Аналіз існуючих виробів та визначення завдань проекту
| <== попередня сторінка | | | наступна сторінка ==> |
| Втрати гумусу від ерозії | | | Лабораторна робота № 4 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |