
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Броунівський рух зовсім хаотичний, тобто в ньому спостерігається повна рівноправність всіх напрямків.
Якщо частинка дисперсної фази досить мала, то під дією ударів, що наносять їй молекули середовища з усіх сторін, вона буде переміщатися в різних напрямках.Чим менший розмір частинок, тим інтенсивнішим їх броунівський рух.
 Число ударів, яке одержує частинка, дуже велике, і тому вона при своєму переміщенні постійно змінює напрямок і швидкість.Шлях частинки виміряти неможливо, і зазвичай визначають відстань, на яку вона зміщується в одиницю часу.
Число ударів, яке одержує частинка, дуже велике, і тому вона при своєму переміщенні постійно змінює напрямок і швидкість.Шлях частинки виміряти неможливо, і зазвичай визначають відстань, на яку вона зміщується в одиницю часу.
Рис.6. Броунівський рух дисперсної частинки.
Інтенсивністьруху частинки збільшується зі зменшенням в’язкості рідини та з підвищенням температури.Броунівський рух не припиняється з часом, тобто не залежить від тривалості існування системи.
Для кількісних розрахунків беруть не саме зміщення, а його проекцію Δх. На рис.6 зображено розташування частинки, яке спостерігається в мікроскопі через рівні проміжки часу. Частинка здійснює складний зигзагоподібний шлях, що складається з прямолінійних ділянок різної довжини.
На основі молекулярно-кінетичних уявлень про природу броунівського руху Ейнштейн і Смолуховський вивели рівняння для кількісної оцінки броунівського руху частинок:
_______
Δх = 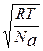 ∙τ/3πη∙r
∙τ/3πη∙r
де Δх - середній квадратичний зсув частинки за час τ ;
Nа - число Авогадро;
η - в'язкість дисперсійного середовища;
r - радіус частинки дисперсної фази.
Середній квадратний зсув як будь-яка середньо квадратична розраховується за рівнянням:
Δх = 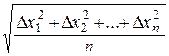
Δx1, Δx2,…Δxn - окремі проекції зсуву;
n - число проекцій взятих для розрахунку.
Рівняння Ейнштейна-Смолуховського неодноразово перевірялося і експериментально була доведена його вірність. Спостереження броунівського руху і розрахунки за вказаними рівняннями переконливо довели реальність атомів і молекул, дозволили створити молекулярно-кінетичну теорію будови матерії.
Броунівський рух є причиною дифузії частинок в колоїдних системах.
Дифузія - самовільне вирівнювання концентрацій, що спостерігається в будь-яких дисперсних системах, частинки яких знаходяться в русі.
Швидкість дифузії пропорційна різниці концентрації і температурі, обернено пропорційна в'язкості дисперсійного середовища і розміру дифундуючих частинок. В колоїдних системах, частинки яких мають розміри порядку 10-7- 10-5см, тобто значно більші молекул низькомолекулярних речовин, швидкість дифузії дуже не велика і значно менша, ніж швидкість дифузії в молекулярних або іонних речовинах. Чим більший розмір частинок, тим меншою буде швидкість дифузії. Колоїдні частинки дифундують в сотні і тисячі разів повільніше, ніж молекули та іони низькомолекулярних речовин.
Дифузія припиняється з досягненням рівномірного розподілу частинок по всьому об’єму. Отже, дифузія можлива лише в системах з неоднаковими концентраціями. Швидкість дифузії залежить від величини і форми частинок. Колоїдні системи, як і істинні розчини, володіють осмотичним тиском, хоча у золей він дуже малий. За законом Вант-Гофа осмотичний тиск розчинів не електролітів визначається рівнянням:
π = 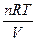 = сRТ; с = n/V
= сRТ; с = n/V
де π-осмотичний тиск, Па;
V - об”єм розчину, м3;
n - кільсість розчиненої речовини (моль);
Т- абсолютна температура, К;
R - постійна газова стала, R =8,314 Дж/(моль∙К);
с – концентрація колоїдної системи, її визначають не молями, а кількістю частинок, що міститься в одиниці об’єму чи маси розчинника.
Це рівняння можна записати у вигляді:
π = 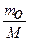 RТ , (2.1)
RТ , (2.1)
де т0 - маса речовини, розчиненої в 1л розчину, яку можна представити як т0 = m∙v, m — маса однієї частинки, ν- часткова концентрація;
М - маса одного моля розчиненої речовини, М=m∙Na, і тоді рівняння (2.1)
можна записати у вигляді:
п = 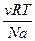 (2.2)
(2.2)
Отже, осмотичний тиск залежить тільки від числачастинок в одиниці об'єму розчину і не залежить від природи і розміру частинок.
При однаковій масовій концентрації часткова концентрація колоїдних розчинів завжди менша, ніж у істинних розчинів, тому і осмотичний тиск колоїдних розчинів повинен бути дуже низьким.
Для двох колоїдних розчинів з однаковою масовою концентрацією, виходячи з рівняння (2.2) можна записати:
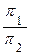 =
= 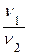
Якщо прийняти, що колоїдні частинки мають форму кулі, то:
m = 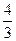
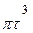 р,
р,
тоді 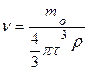 , де τ - радіус частинки,
, де τ - радіус частинки,
ρ - густина речовини дисперсної фази. 
В результаті підстановки, одержимо:
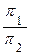 =
= 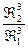
Таким чином, осмотичний тиск колоїдного розчину обернено пропорційний кубу радіуса частинок дисперсної фази.Цим пояснюється не тільки малий осмотичний тиск колоїдних систем, але й його непостійність. Тому проводити точні вимірювання осмотичного тиску колоїдних розчинів дуже складно і проводять їх дуже рідко.
На відміну від колоїдних, розчини високомолекулярних сполук можна ретельно очистити від дрібномолекулярних домішок. Тому осмотичні методи визначення їх молекулярної маси мають практичне застосування. До речі, кров (лімфа, між- та внутріклітинні рідини, інші біологічні рідини) за своєю природою є складним розчином з певними значеннями осмотичного тиску. Осмотичний тиск крові рівний тиску 0,85%-го розчину NaCl і тому останній отримав назву фізіологічний (ізотонічний)розчин. При змішуванні такого розчину з кров’ю не відбувається зморщування еритроцитів, що треба мати на увазі при введенні в кров різноманітних фармакологічних препаратів.
Для колоїдних систем характерна агрегація (або дезагрегація) частинок, в результаті чого розмір їх збільшується (або зменшується), відповідно змінюється і осмотичний тиск.
Читайте також:
- Part A. Зовсім нескладний eтикет.етикет.
- А є А, тобто усякий предмет є те, що він є.
- Активна та повна потужності
- Аналіз вимог та динаміки попиту на міжнародному та внутрішньому ринку туристичних послуг (за видами туризму, за категоріями туристів, цілей та об’єктів відвідування)
- Б) Перекладіть текст з урахуванням Вашого фаху, знайдіть у ньому займенникові форми і охарактеризуйте особливості їх вживання у науковому тексті.
- Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- В крайньому випадку, записи мають бути тезисні, в які ви можете заглянути у крайньому випадку (при загрозі краху, загибелі тощо).
- В пізньому палеозої
- В Україні немає свого фільмофонду і державного кіномузею, низький рівень кіноосвіти. Зовсім зникла кінопреса (журнали “Новини кіноекрана”, “Вавилон”).
- Важливе місце при цьому приділялося так званій «сімейній дипломатії», тобто укладенню вигідних союзів і угод шляхом династичних шлюбів.
- Важливим параметром конденсаторів є пробивна напруга конденсатора. Чим вона більша, тим надійніший конденсатор, тим більша енергія може сконцентруватись на ньому.
| <== попередня сторінка | | | наступна сторінка ==> |
| ТЕОРІЯ БРОУНІВСЬКОГО РУХУ | | | ДИФУЗІЙНО-СЕДИМЕНТАЦІЙНА РІВНОВАГА |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |