
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Коагулююча здатність іона тим більша, чим більший його заряд.
Коагулююча здатність одно-, дво- і тризарядних катіонів співвідноситься: 1:20:350. Правило Шульце-Гарди має наближений характер і описує дію іонів лише неорганічних сполук.
3. У ряді органічних іонів коагулююча здатність зростає із підвищенням адсорбційної здатності. Іони органічних з’єднань завжди мають більш високу коагулюючу здатність, ніж іони неорганічних речовин.
4. У ряді неорганічних іонів з однаковим зарядом, коагулююча дія зростає зі зменшенням гідратації. Наприклад, у рядах одновалентних катіонів і аніонів коагулююча активність і гідратація змінюються таким чином:

Зростання коагулюючої активності

Li+ Na+ K+ Rb+

Зростання ступеня гідратації
Зростання коагулюючої активності

Cl- Br- J- CNS-
Зростання ступеня гідратації
Іони з однаковими зарядами мають близькі значення коагулюючої дії, але вона все ж таки зростає зі збільшенням радіуса іона, тобто зі зменшенням радіуса гідратованого іона. Коагулююча дія іона тим сильніша, чим слабше він гідратований.
5. Початку коагуляції відповідає зниження ξ – потенціалу до критичної величини (≈30мВ).
6. В осаді, утвореному при коагуляції, завжди присутні іони, які її викликали.
Стійкість колоїдного розчину можна збільшити, додаючи до нього невелику кількість високомолекулярної речовини. Це явище називається колоїдним захистом.
Механізм захисної дії зводиться до утворення навколо колоїдної частинки адсорбційної оболонки із високомолекулярної речовини.

Рис.27. Частинки золю, що захищені оболонкою з ВМС
Макромолекули полімеру, адсорбуючись на поверхні міцели, утворюють міцну оболонку, що запобігає злипанню колоїдних частинок. Захисна дія має велике значення у фармацевтичній і харчовій промисловості, при виробництві вина, пива, морозива, кондитерських виробів тощо.
Дезагрегацією абопептизацієюназивають процес, зворотній коагуляції.
Якщо при коагуляції частинки золя укрупнюються і випадають в осад, то при пептизації частинки осаду переходять в розчин, утворюючи золь. На пептизацію впливає механічна дія. Так, перемішування сприяє пептизації. Швидкість пептизації збільшується із підвищенням температури. З пептизацією, наприклад, пов’язане очищення поверхні від бруду. Частинки бруду за допомогою мила або СМЗ (пептизатор) відриваються від поверхні (пептизуються) і переходять 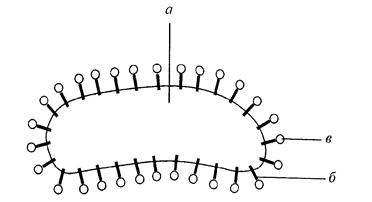 в стан золю.
в стан золю.
Рис. 28. Схема миючої дії розчину мила:
а – гідрофобна частинка бруду; б – гідрофобна (вуглеводнева)
в – гідрофільна (карбоксильна) частина молекули мила.
 Концентраційна коагуляція спостерігається при збільшенні концентрації електроліту, що не вступає в хімічну взаємодію з компонентами колоїдного розчину. Такі електроліти називаються індиферентними; вони не повинні мати іонів, здатних добудовувати кристалічну гратку агрегату колоїдної міцели і вступати в реакцію з потенціал визначаючим іоном. При збільшенні концентрації індиферентного електроліту дифузний шар противоіонів міцели стискається, перейшовши в адсорбційний шар. В результаті зменшується електрокінетичний потенціал, і він може стати рівним 0. Такий стан колоїдної системи називається ізоелектричним.
Концентраційна коагуляція спостерігається при збільшенні концентрації електроліту, що не вступає в хімічну взаємодію з компонентами колоїдного розчину. Такі електроліти називаються індиферентними; вони не повинні мати іонів, здатних добудовувати кристалічну гратку агрегату колоїдної міцели і вступати в реакцію з потенціал визначаючим іоном. При збільшенні концентрації індиферентного електроліту дифузний шар противоіонів міцели стискається, перейшовши в адсорбційний шар. В результаті зменшується електрокінетичний потенціал, і він може стати рівним 0. Такий стан колоїдної системи називається ізоелектричним.
Із зменшенням електрокінетичного потенціалу, агрегативна стійкість колоїдного розчину знижується і при деякому значенні ξ – потенціалу починається коагуляція. Поверхневий потенціал при цьому не змінюється.
При нейтралізаційній коагуляції іони електроліту нейтралізують потенціал визначаючі іони, зменшується поверхневий термодинамічний потенціал φ і, відповідно, зменшується ξ – потенціал.
В порівнянні з ліофобними золями ліофільні золі більш агрегативно стійкі. Якщо для коагуляції гідрофобного золю достатньо дуже незначну кількість електроліта, то для коагуляції ліофільного золю, тобто для руйнування сольватної (гідратної) оболонки, необхідна концентрація електроліту, що складає порядку кілька молей на літр.
Читайте також:
- V здатність до встановлення та підтримки гарних особистих стосунків і веденню етичного способу життя.
- Абсолютний фагоцитоз або елімінуюча здатність крові (ЕЗК) — це кількість фагоцитованих мікробних клітин лейкоцитами 1 мкл крові.
- АЧТ-це тіло, поглинальна здатність якого (для всіх довжин хвиль) тотожне 1.
- Бистрість – це здатність людини до термінового реагування на подразники та до високої швидкості рухів, що виконуються при відсутності значного зовнішнього опору.
- Будова та реакційна здатність
- В електронагрівачах використано одну з головних властивостей електричного струму - здатність нагрівати провідники.
- Важливим параметром конденсаторів є пробивна напруга конденсатора. Чим вона більша, тим надійніший конденсатор, тим більша енергія може сконцентруватись на ньому.
- Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук.
- Вибухова сила – це здатність людини проявити свої максимальні силові можливості за найкоротший час.
- Виробництво та його фактори: земля, праця, капітал, здатність до підприємництва
- Вплив освітлення на здоров’я та працездатність людини.
- Дифузія газів у легенях. Дифузійна здатність легень і фактори, від яких вона залежить.
| <== попередня сторінка | | | наступна сторінка ==> |
| Поріг коагуляції – це мінімальна концентрація електроліту при перевищенні якої спостерігається коагуляція. | | | КОАГУЛЯЦІЙНІ МЕТОДИ ОЧИЩЕННЯ ПРОМИСЛОВИХ ВОД НА ПІДПРИЄМСТВАХ ХАРЧОВОЇ ПРОМИСЛОВОСТІ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |