
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
СПРЯЖЕНІ СИСТЕМИ
Якщо молекула належить до насичених сполук і містить тільки s-зв¢язки, взаємний вплив здійснюється через індуктивні ефекти, але у молекулах більш складної будови може виявлятися дія інших ефектів. Розглянемо спряжені системи.
Спряження – взаємодія між орбіталями окремих фрагментів молекули, які утворюють p-зв¢язки чи містять неподілені електронні пари атомів електронегативних елементів (0, S, N), що знаходяться у ланцюгу.
Найчастіше зустрічаються два типи спряження: π,π- або р,π-спряження.
І. π,π-Спряження відбувається, коли прості і кратні (подвійні чи потрійні) зв’язки розміщуються в молекулі почергово, наприклад:
СН2=СН–СН=СН–СН=СН2, СН≡С–СН=СН–С≡СН, СН≡С–СН=СН2.
Найпростішим прикладом π,π-спряження є будова бутадієну-1,3 (рис.9.1а): в ньому всі чотири атоми карбону перебувають у sp2-гібридизованому стані, утворюючи по три гібридизовані орбіталі, вісі яких розміщуються на одній площині під кутом 120о. Кожна з цих орбіталей при перекривання з гібридизованою орбіталлю сусіднього атома С чи з s-орбіталлю атома Н утворює s-зв’язок, а разом вони складають s-скелет молекули (рис.9.1).
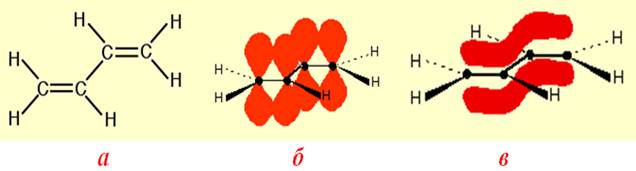
Рисунок 9.1 – Будова бутадієну-1,3: а) структура, що відображає плоский σ-скелет молекули; б) взаємне розташування pz-електронних негібридизованих орбіталей чотирьох атомів С; в) утворення спряженої системи – єдиной p-електронної хмари над і під площиною σ-скелету молекули
Вісі sp2-гібридизованих орбіталей знаходяться на одній площині, а негібридизовані рz-орбіталі кожного атома карбону перпендикулярні до площини s-скелету і паралельні одна відносно одної (рис. 9.1б). Це створює умови їх взаємного перекривання не тільки між атомами С1-С2 і С3–С4, але й частково – між С2–С3. Завдяки такому боковому перекриванню чотирьох рz-орбіталей утворюється єдина p-електронна хмара – p,p-спряження зв¢язків, при якому p-електрони вже не належать окремим зв¢язкам, а делокалізуються по спряженій системі в цілому (рис. 9.1в).
Делокалізація електронної густини – це її розподілення по всій спряженій системі, по всіх зв¢язках і атомах.
Делокалізація p-електронів супроводжується виділенням енергії. Оскільки спряжені системи мають менший запас енергії, вони виявляють більшу стійкість порівняно з ізольованими алкадієнами. Енергія, що вивільняється за рахунок спряження, називається енергією делокалізації, або енергією спряження; для бутадіну-1,3 вона складає 15кДж/моль. Завдяки утворенню спряженої системи довжини зв¢язків частково вирівнюються і стають меншими, ніж довжина одинарного зв¢язку в алканах (0,154нм), але більшими, ніж довжина подвійного зв¢язку в алкенах (0,133нм).
Необхідно чітко уявляти, що у випадку ізольованих кратних зв’язків спряження не виникає, оскільки p-зв’язки віддалені один від одного на значну відстань і тому перекривання не гібридизованих рz-орбіталей не відбувається, як це видно на прикладі пентадієну-1,4 (рис.9.2).

Рисунок 9.2 – Пентадієн-1,4: а) структурна формула; б) розташування орбіталей, що утворюють π-зв’язки, які відділяються один від одного метиленовою групою –СН2–, яка перешкоджує виникненню спряження
Аналогічна картина спостерігається і в тих сполуках, в яких подвійні зв’язки розташовані поруч: спряження теж неможливо. Справа в тому, що делокалізація електронної густини є найефективнішою, якщо взаємодіючі орбіталі компланарні (знаходяться в одній площині). Якщо ж вісі орбіталей, що утворюють два сусідні π-зв’язки, взаємно перпендикулярні, спряження не виникає, як це видно на прикладі алену СН2=С=СН2 (рис. 9.3).
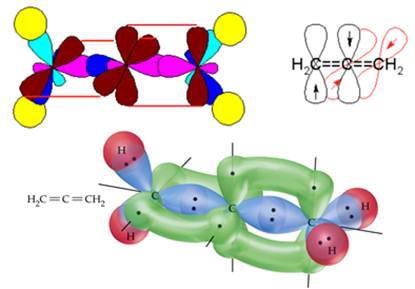
Рисунок 9.3 – Будова алену (пропадієну) – два сусідні π-зв’язки розміщуються у взаємно перпендикулярних площинах, що перешкоджує можливості спряження
Ще один важливий випадок π,π-спряження відбувається в ароматичних сполуках – у молекулах бензені та його гомологів. Поняття ароматичність об¢єднує сукупність певних ознак, які визначаються за правилом Хюккеля:
Ароматичною називається замкнута система, що має плоский циклічний s-скелет і 4n+2 узагальнених p-електрони, де n =1,2,3…
Структура молекули бензену С6Н6 ідеально відповідає правилу ароматичності Хюккеля, оскільки в ній всі шість атомів С перебувають у стані sp2-гібридизації. Внаслідок цього вісі трьох sp2-гібридизованих одноелектронних орбіталей кожного атома С знаходяться на одній площині під валентним кутом 1200 (рис. 9.4а), а вісь четвертої, негібридизованої рz-орбіталі розміщується перпендикулярно до них (рис. 9.4б). Кожний атом карбону утворює за рахунок гібридизованих орбіталей три s-зв¢язки: два – із сусідніми атомами карбону, а третій – при перекриванні зі сферичною s-орбіталлю атома гідрогену. Отже, всі s-зв¢язки в молекулі С6Н6 є копланарними – такими, що лежать на одній площині. Таким чином, шість атомів С без напруження замикаються за допомогою s-зв¢язків у правильний шестикутник – так званий s-скелет молекули.
Колове спряження та вирівнювання довжин зв¢язків приводить до того, що зв¢язки у бензені не можуть вважатися одинарними чи подвійними. На основі точних фізико-хімічних методів дослідження встановлено, що насправді кратність зв¢язків С–С у молекулі бензену становить 1,67. Шість негібридизованих рz-орбіталей, які розміщуються перпендикулярно до s-скелету і паралельно одна до одної (рис. 9.4б), взаємно перекриваються, утворюючи єдину делокалізовану p-електронну хмару, тобто виникає колове π,π-спряження (рис. 9.4в). Найбільша електронна густина в цій спряженій системі розміщується над і під площиною s-скелету молекули і однаковою мірою охоплює всі шість атомів С у циклі.
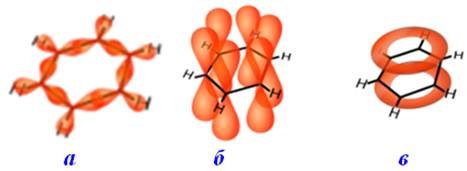
Рисунок 9.4 – Будова молекули бензену: а) копланарний s-скелет молекули, утворений σ-зв‘язками (шість С–С при взаємному перекриванні sp2-гібридизованих орбіталей сусідніх атомів карбону і шість С–Н при перекриванні sp2-гібридизованих орбіталей атомів карбону з s-орбіталями атомів Н); б) розташування негібридизованих pz-орбіталей перпендикулярно до площини σ-зв‘язків; в) утворення колового спряження делокалізованої p-електронної хмари
Завдяки коловому спряженню всі зв¢язки між атомами карбону вирівнюються, вони мають однакову довжину (0,139нм), яка є проміжною між довжиною подвійного зв¢язку в алкенах (0,133нм) і одинарного в алканах (0,154нм).
Будову бензену зображують графічними формулами Кекуле (рис. 9.5а і 9.5б), яка показує рівноцінність всіх шести атомів карбону в бензені, але не відображає його властивостей. Наприклад, незважаючи на ненасиченість, бензен не дає типових якісних реакцій на подвійні зв’язки: не знебарвлює бромну воду і розчин калій перманганату.
Вирівнювання зв¢язків С–С у бензені графічно показують за допомогою правильного кола, розміщеного всередині правильного шестикутника (рис. 9.5в):

Рисунок 9.5 – Графічне зображення молекули бензену: а) структурна формула Кекуле;
б) раціональна формула; в) структурна формула, що показує колове спряження
Колове спряження у молекулі бензену зумовлює велику енергією спряження (або енергію делокалізації), що дорівнює 150,7 кДж/моль.
Електронна будова і ароматичність бензену зумовлює його властивості, у тому числі, високу термічну стійкість (він не розкладається навіть при нагріванні до 9000С), відсутність схильності до реакцій приєднання (незважаючи на велику ненасиченість).
ІІ. р,π-Спряження виникає в системі з таким чергуванням фрагментів: подвійний зв’язок – одинарний s-зв’язок – р-орбіталь. Причому, р-орбіталь може містити неподілену електронну пару, один неспарений електрон чи бути вакантною (0 електронів). Відповідними до такої кількості електронів прикладами р,p-спряження можуть бути системи типу СН2=СН–Х, в яких замісником Х виступає або атом галогену (:F, :Cl, :Br, :I) (рис. 9.6а), або sp3-гібридизований атом карбону ·CH2, в якому на орбіталі міститься один неспарений електрон (його позначають точкою) (рис. 9.6б), або sp3-гібридизований атом карбону з вакантною орбіталлю □C+H2 (у формулі вакантна орбіталь позначається за допомогою квадратика квантової комірки), за рахунок чого на ньому скупчується позитивний заряд, – так званий карбоній-катіон (рис. 9.6в).

Рисунок 9.6 – р,π-Спряження: а) хлорвініл ; б) радикал аліл; в) алільний карбоній-катіон
Читайте також:
- I. Органи і системи, що забезпечують функцію виділення
- I. Особливості аферентних і еферентних шляхів вегетативного і соматичного відділів нервової системи
- II. Анатомічний склад лімфатичної системи
- IV. Розподіл нервової системи
- IV. Система зв’язків всередині центральної нервової системи
- IV. Філогенез кровоносної системи
- POS-системи
- VI. Філогенез нервової системи
- Автокореляційна характеристика системи
- АВТОМАТИЗОВАНІ СИСТЕМИ ДИСПЕТЧЕРСЬКОГО УПРАВЛІННЯ
- АВТОМАТИЗОВАНІ СИСТЕМИ УПРАВЛІННЯ ДОРОЖНІМ РУХОМ
- Автоматизовані форми та системи обліку.
| <== попередня сторінка | | | наступна сторінка ==> |
| ІНДУКТИВНИЙ ЕФЕКТ | | | МЕЗОМЕРНИЙ ЕФЕКТ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |