
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реактиви
Вихідний розчин перманганату калію, 0,1 моль-екв/дм3: 3,2 г КМnO4 ч.д.а., розчиняють у 1 дм3 дистильованої води. Розчин зберігають у пляшці з темного скла, використовують через 15-20 діб після приготування.
Розчин перманганату калію, 0,01 моль-екв/дм3: 100 см3 відстояного вихідного розчину КМnO4 розбавляють до 1 дм3 дистильованою водою. Розчин зберігають у пляшці з темного скла. Через кілька днів установлюють його концентрацію.
Для визначення концентрації розчину перманганату калію в конічну колбу місткістю 250 см3 наливають 100 см3 бідистильованої води, добавляють 10,0 см3 розчину перманганату калію, 5 см3 розчину сірчаної кислоти (1:3), приблизно 0,5 г КІ і титрують 0,01 моль-екв/дм3 розчином тіосульфату натрію, як описано в методиці визначення.
Концентрацію розчину КМnO4 моль-екв/дм3 обчислюють за рівнянням:
СKMnO4= 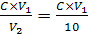 ,
,
С — концентрація розчину тіосульфату натрію, моль-екв/дм3; V1 — об'єм розчину тіосульфату натрію, витрачений на титрування, см3; V2 — об'єм розчину перманганату калію, см3.
Якщо визначена концентрація КМnO4 відрізняється від 0,01 моль-екв/дм3 більше ніж на 5%, для приготування 0,01 моль-екв/дм3 розчину КМnO4 беруть 100k см3 вихідного розчину КМnO4, де k=0,01 /С КМnO4.
Розчин тіосульфату натрію, 0,01 моль-екв/дм3 : наважку 2,5 г Na2S2O3·5H2O, ч.д.а., розчиняють в 1 дм3 кип’яченої дистильованої води. Добавляють 1-2 см3 ксилолу або хлороформу і зберігають у пляшці з темного скла. Розчин використовують через 10 діб після приготування.
Для визначення точної концентрації розчину в колбу місткістю 250 см3 наливають 50 см3 дистильованої води, 15,0 см3 0,01 моль-екв/дм3 розчину К2Сr2O7, 10 см3 розчину Н2SО4 (1:3) і добавляють 0,5 г сухого КІ. Після розчинення КІ титрують розчином тіосульфату натрію до досягнення світло-жовтого забарвлення суміші. Добавляють 100 см3 дистильованої води, 1 см3 розчину крохмалю і продовжують титрувати до зникнення синього кольору розчину.
Титрування проводять тричі й для розрахунків беруть середній результат.
Концентрацію розчину тіосульфату натрію Сх (моль-екв/дм3) обчислюють за рівнянням:
Сх= 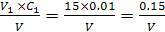 ,
,
де V1 — об'єм розчину дихромату калію, см3; С — концентрація розчину дихромату калію, моль-екв/дм3;V — об'єм розчину тіосульфату натрію, витраченого на титрування, см3 .
Розчин дихромату калію, 0,01 моль-екв/дм3: 0,490±0,001 г К2Сr2O7, х.ч., висушеного при 105 оС упродовж 2 год., розчиняють у дистильованій воді й доводять об’єм розчину до 1 дм3 у мірній колбі.
Розчин сірчаної кислоти (1:3): 1 об’єм концентрованої Н2SО4, х.ч., за перемішування доливають малими порціями дистильованої води до 3 об’ємів.
Розчин крохмалю, 0,5%-й.
Йодид калію КІ, х.ч., кристалічний.
Читайте також:
- Аналітичні реакції (реактиви)
- Реактиви
- Реактиви
- Реактиви
- Реактиви
- Реактиви
- Реактиви
- Реактиви
- Реактиви
- Реактиви
- Реактиви
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Порядок виконання роботи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |