
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Лекція 3
§4. Взаємозв’язок між дифузною та регулярною оптичною густиною
Між дифузною та регулярною оптичною густиною існує залежність
 або
або 
Якщо а=1, то  або
або 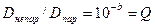 - коефіцієнт Кал’є.
- коефіцієнт Кал’є.
Ця величина зменшується з ростом оптичної густини.
Ефект Кал’є може бути використаний для оцінки фотографічної зернистості, оскільки Q залежить від ступеня неоднорідності проявленого потемніння.
Дані зміни Q пов’язані з впливом структури срібного відкладення, що залежить від дисперсності твердої фази емульсії, впливає на покривальну здатність і, як наслідок, на оптичну густину проявленого зображення.
§5. Ефективність взаємодії випромінювання з речовиною
Реакційна здатність хімічних реагентів визначається, крім їх хімічної природи, зовнішнім енергетичним впливом, який може бути створений зокрема, дією температури або електромагнітного опромінення. Під дією енергії молекули або атоми можуть переходити у збуджений стан, в якому вони мають не лише надлишкову енергію порівняно з основним стійким станом, але й інші фізичні та хімічні властивості.
При збудженні молекул може змінюватися:
- довжина хімічного зв’язку;
- дипольний момент;
- поляризація;
- геометричні параметри молекул;
- перерозподіл електронної густини;
- кислотно-основні властивості.
Повна енергія молекул складається з кінетичної енергії їх руху в просторі, коливальної енергії ядер, обертової енергії відносно центру ваги і електронної енергії. Основний внесок у енергетичний стан молекули робить електронна енергія.
Кожний електронний стан має характерний розподіл енергії, електронної густини, орієнтації спінів і часу життя.
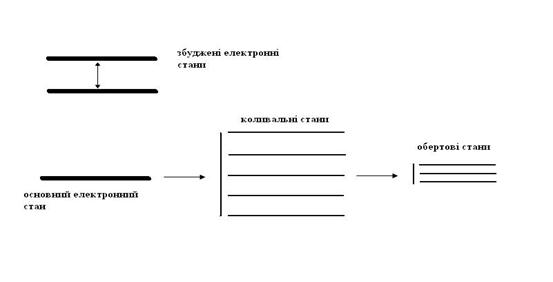
Будь-який електронний стан містить декілька коливальних рівнів, кожний з яких складається з декількох обертових станів.
Енергія електронних станів – 102÷104 кДж/моль;
енергія коливальних станів –10 кДж/моль;
енергія обертових станів – 0,1 кДж/моль;
При підвищенні температури в системі зростає кінетична енергія поступального та обертового руху молекул, а також енергія коливального руху ядер атомів. Під впливом електромагнітного опромінення в ультрафіолетовому та видимому діапазоні може змінюватись енергія електронів у молекулах. При поглинанні квантів світла відбувається перерозподіл електронів між зайнятими та вакантними електронними орбіта лями.
Електронні стани молекул, що мають мінімальну енергію, називають основними, а на більш високих рівнях – збуджені. Збуджені стани з надлишковою електронною та коливальною енергією – вібронні стани.
Кожний енергетичний стан описується відповідною функцією потенціальної енергії. Про характер розподілу електронної густини в атомах і молекулах свідчить вигляд хвильвої функції (Ψ).
Ця функція описує рух (розподіл) електронів довкола ядра або декількох ядер за допомогою рівняння Шредінгера.
Квадрат модуля даної функції визначає ймовірність розташування електронів у певній точці простору.
Для S-електронів найбільш імовірно розташування електронів на поверхні сфери. Чим вищий електронний рівень, тим більший радіус сфери. Енергія електронного стану залежить від загального спінового квантового числа

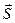 – векторна сума спінів електронів
– векторна сума спінів електронів  , що визначає мультиплетності молекули М.
, що визначає мультиплетності молекули М.
Мультиплетність молекули – це число квантових станів, які відрізняються орієнтацією сумарного електронного спіну:

Для парного числа електронів можливим є значення мультиплетності 1,3,5… (синглетні, триплетні, квінтетні…); для непарного мультиплетність рівна 2,4,6 і, відповідно, дублетні, квартетні, секстетні.
Для молекул з антипаралельними спінами валентних електронів,  , М=1, якщо спіни орієнтовані паралельно,
, М=1, якщо спіни орієнтовані паралельно, 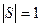 , М=3.
, М=3.
Синглетні стани – S, триплетні – Т.
Синглетні та триплетні стани самих молекул різняться між собою. Енергія синглетного стану вища, ніж відповідного за електронним станом триплетного рівня, внаслідок взаємного відштовхування електронів з однаковими спінами (правило Гунда).
Триплетні стани стабільніші, тобто мають більший час життя порівняно з синглетними.
Тривалість життя (час) електронного стану визначається середньою тривалістю перебування молекули чи атома у цьому стані. Молекули, що перебувають в основних електронних станах, стабільні, тож їх тривалість життя – нескінченно велика. Час життя у нестабільному стані складає 10-3÷10-9сек.
За існуючою класифікацією розрізняють σ-, π-, n- електрони, залежно від того, в утворенні яких хімічних зв’язків вони беруть участь. Хвильові функції, що описують розподіл електронів у хімічних зв’язках, називають хвильовими функціями молекулярних орбіталей.
Хвильові функції зв’язуючих молекулярних орбіталей, які позначаються буквами σ- та π-, характеризуються підвищеною електронною густиною в міжядерному просторі. А відповідно, σ* та π* мають мінімальну електронну густину в міжядерному просторі.
Електронні переходи між енергетичними рівнями записують, позначаючи конфігурацію вихідної і кінцевої хвильової функції:
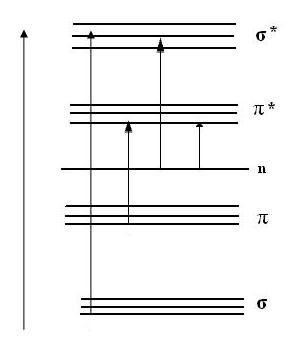
Згідно з квантово-механічними розрахунками встановлено певні обмеження для можливості здійснення електронних переходів, наприклад між різними мультиплетними станами, тощо.
Кількісною характеристикою, що свідчить про можливість електронного переходу є коефіцієнт молярного поглинання (ε) або його логарифм (lgε) для максимальної довжини хвилі смуги поглинання.
Ймовірні за квантово-механічними правилами переходи називають дозволеними,і вони мають великі значення коефіцієнта молярного поглинання.
Електронний перехід триває миттєвий проміжок часу (10-15сек), який дорівнює періоду коливань світлової хвилі, тобто на 2-3 порядки менший від періоду коливань атомних ядер. Тобто відносне розташування ядер за час електронного збудження не змінюється (принцип Франка-Кондона).
Електронний перехід також завжди супроводжується зміною енергії коливальних станів. Тобто можна говорити про різні електронно-коливальні стани.
Тривалість життя молекули (τ) у збудженому стані залежить від швидкості процесів дезактивації збудженого стану
 ,
,
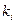 - константа швидкості будь-якого мономолекулярного процесу дезактивації збудженого стану.
- константа швидкості будь-якого мономолекулярного процесу дезактивації збудженого стану.
Якщо збуджені молекули втрачають свою надлишкову енергію внаслідок випромінювання (люмінесценції), час життя збудженого стану обернено пропорційний до максимального молекулярного коефіцієнту екстинції в смузі поглинання.
Тоді
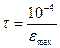 ,
,
Надлишкова енергія, яку акумулювала молекула внаслідок збудження, може бути витрачена (деградована) різними шляхами:
- випромінювання енергії (випромінювальні процеси);
- безвипромінювальні процеси (коливальна релаксація, гасіння, перенесення енергії, хімічні реакції).
Явище випромінювання світла електронно-збудженими молекулами називають люмінесценцією. Дослідження люмінесценції дає можливість проаналізувати перебіг первинних фотохімічних процесів.
Речовини, які здатні на яскраву люмінесценцію – люмінофори. Розрізняють неорганічні та органічні.
Структура збуджених станів

Випромінювальні процеси: поглинання і люмінесценція (флуоресценція, фосфорисценція) світла. Флуоресценція і фосфоресценція характеризуються різним часом залишкового світіння (після опромінення). Для флуоресценції випромінювання припиняється з припиненням збудження.
Флуоресценція і фосфоресценція – утворення збуджених молекул внаслідок поглинання видимого чи ультрафіолетового світла.
Флуоресценція – дозволений перехід між двома станами однакової мультиплетності. Це дуже швидкий процес з константою швидкості в інтервалі 106÷109с-1. Довжина хвилі флуоресценції звичайно є довшою від довжини хвилі збуджувального світла, що зумовлено наявністю процесів коливальної релаксації світла. Флуоресценція спостерігається для речовини, яка має будь-який агрегатний стан: газоподібний, рідкий, чи твердий.
Фосфоресценція – це заборонений перехід між двома електронними станами різної мультиплетності. Незважаючи на існування теоретичної заборони таких переходів, вони мають місце внаслідок спін-орбітальної взаємодії електронів. Швидкість процесу фосфоресценції значно менша порівняно з флуоресценцією константи швидкості в межах 10-2÷104с-1. Фосфорисценція спостерігається для речовини, що має твердий агрегатний стан.
Коливальна релаксація – це процес втрати енергії збудження внаслідок зштовхування збудженої молекули з незбудженими молекулами речовини і перетворення надлишкової енергії збудження в кінетичну енергію молекул речовини. Цей процес відіграє важливу роль в явищах теплообміну. Константа швидкості коливальної релаксації знаходиться в межах 1012÷1014с-1.
Гасіння – це процес дезактивації збуджених станів молекул їх взаємодії з іншими незбудженими молекулами. В цьому процесі, на відміну від коливальної релаксації, енергія збудження переноситься з однієї на іншу молекулу
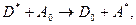
 ,
,  - молекули речовини в основному та збудженому станах (донора);
- молекули речовини в основному та збудженому станах (донора);
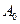 ,
,  - молекули акцептора.
- молекули акцептора.
Синглет-синглетний процес:

Триплет-триплетний перенос:

Процес гасіння має місце при зіштовхуванні молекул. При цьому утворюються ексиплекси або ексимери.
Ексиплекс (М-А)* – комплекс, утворений внаслідок асоціації двох різних молекул, одна з яких перебуває у збудженому стані. Тобто:
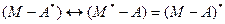
Ексимер (М-М)* - це комплекс, утворений внаслідок асоціації двох однакових молекул, одна з яких перебуває у збудженому стані. Тобто:
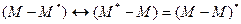
Є два механізми трансляції електронної енергії збудження від однієї до іншої молекули: випромінювальний та безвипромінювальний.
Випромінювальний – поглинання енергії гасінням, яку випромінюють збуджені молекули→перенесення енергії на значну відстань.


Безвипромінювальні процеси – двох типів: резонансний і обмінний.
Резонансний процес (кулонівська взаємодія) відбувається внаслідок диполь-дипольної взаємодії збудженої молекули і молекули гасія. Такий механізм процесу створює умови для перенесення енергії на відстань до 50 А°>> розміру більшості молекул.
За резонансним механізмом здійснюється синглет-синглетне перенесення енергії.
Обмінний перенос енергії відбувається внаслідок зіштовхування збудженої молекули з молекулою-гасієм (акцептором) енергії.
При цьому відбувається перекривання їх електронних орбіталей, тому для здійснення такого механізму бажаною є відстань між агентами взаємодії близько 10-15 А°. За цим механізмом відбувається триплет-триплетий перенос енергії, що має місце у випадку фотосенсибілізованих реакцій.
Наприкінці 40-х – 50-х років було виявлено явище так званого двоквантового поглинання світла. Згідно з законом Штарка-Ейнштейна для переходу молекули у збуджений стан необхідне поглинання одного кванта. При цьому швидкість утворення продуктів первинних фотохімічних реакцій пропорційна інтенсивності світла. Суть двоквантового процесу полягає у подвійному поглинанні двох квантів світла однією молекулою.
Спочатку молекула поглинає один квант і переходить у збуджений стан, після чого відбувається поглинання ще одного кванта світла уже збудженою молекулою.
Двоквантовий процес:
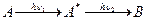
А, А* - молекули в основному і збудженому (триплетному) станах; В – продукт реакції; 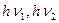 - кванти світла однакової або різної довжини хвилі.
- кванти світла однакової або різної довжини хвилі.
Фактори, які сприяють двоквантовим процесам, є збільшення часу життя збудженого (триплетного) стану А* та величина інтенсивності світла. Швидкість двоквантових процесів має ступеневий характер залежно від інтенсивності світла з показником степеня 1÷2.
Читайте також:
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вид заняття: лекція
- Вступна лекція
- Вступна лекція 1. Методологічні аспекти технічного регулювання у
- Заняття . Лекція № .
- Заняття 10. Лекція № 8
- Заняття 12. Лекція №9.
- Заняття 13. Лекція №10.
- Заняття 7. Лекція № 6.
| <== попередня сторінка | | | наступна сторінка ==> |
| Лекція 2 | | | Лекція 4 |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |