
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
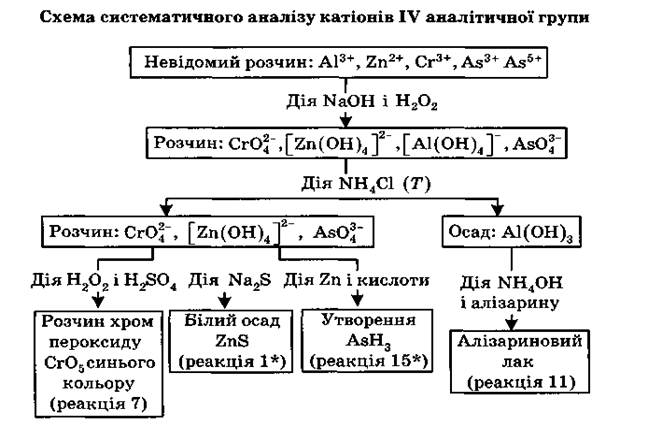
Загальна характеристика групи
До четвертої аналітичної групи належать катіони: Zn2+ , Сг3+ , А13+ , As3+ , As5+ , Sn2+ , Sn4+ . Груповим реактивом є розчин натрій гідроксиду NaOH ,який осаджує всі перелічені катіони у вигляді гідроксидів, що мають амфотерні властивості, тобто розчиняються в кислотах і в надлишку реактиву. Враховуючи значення цих йонів для медицини і фармацевтичного аналізу, розглянемо якісні реакції катіонів Цинку і Хрому, а також Алюмінію й Арсену.
Катіони Цинку і Хрому(III) належать до родини d-елементів, інші є р-елементами. Сполуки Цинку та Алюмінію характеризуються сталою валентністю (II і III), а відповідно, і ступенем окиснення. Хром належить до перехідних металів, тому виявляє різні ступені окиснення: +2, +3, +6. У зв'язку з цим катіони Zn2+ і А13+ легше вступають у реакції комплексо-утворення, а йони Хрому — в окисно-відновні реакції, причому йони з нижчим ступенем окиснення є відновниками, а з вищим — тільки окисниками.
Оксидам з нижчими ступенями окиснення відповідають основи, з вищими — кислоти, а з проміжними — і основи, і кислоти. Кислотно-основні властивості сполук Хрому залежно від його валентності наведено в табл. 12.1:
Катіони четвертої аналітичної групи при взаємодії з лугами утворюють гідроксиди, які відносять до слабких основ. Вони не розчиняються у воді, але розчиняються в кислотах. Виявляючи типові амфотерні властивості, гідроксиди цих катіонів розчиняються не лише в кислотах, а й у лугах. Наприклад:

|
Zn (ОН)2 + 2НС1 = ZnCl2 + 2 Н2О ;
Zn(OH)2+2KOH(p.H)=K2[Zn(OH)4];
Сг(ОН)3+ЗНС1 = СгС13 + ЗН2О;
Сг(ОН)3 +ЗКОН(р.н) =К3[Сг(ОН)6].
У водних розчинах амфотерні електроліти (амфоліти) дисоціюють на йони Гідрогену Н+ і гідроксид-іони ОН" за рівняннями
Zn(OH)2+2H2O ↔ 2H++[Zn(OH)4]2ˉ (як кислота);
Zn (OH)2 ↔ ZnOH+ + ОНˉ І ступінь (як основа);
ZnOH+ ↔ Zn2+ + ОНˉ ІI ступінь
.
Середні солі катіонів третьої групи — хлориди, нітрати, сульфати й ацетати — добре розчиняються у воді, а сульфіди, карбонати й фосфати у воді не розчинні, але добре розчиняються в кислотах.
Оскільки розчинні у воді солі утворені слабкими основами типу Zn(OH)2, А1(0Н)3, Сг(ОН)3, то практично всі вони гід-ролізують (див. п. 3.5), наприклад:
Zn2++НОН ↔ ZnOH+ + Н+ .
У результаті гідролізу утворюються основні солі, а реакція середовища стає кислотною (рН < 7).
Солі, що містять катіон слабкої основи і аніон слабкої кислоти, наприклад карбонати або сульфіди Алюмінію і Хрому(ІII), у водних розчинах не існують, оскільки вони гідролі-зують повністю:
Сг2 (СО)3+ЗНОН → 2Сг(ОН)3↓+ ЗСО2 ↑ ;
Cr2S3 + 6HOH → 2Cr(OH)3↓+ 3H2S↑.
Алюміній — один із найпоширеніших металів земної кори (8 % за масою). Він належить до хімічно активних елементів, його сполуки виявляють типові амфотерні властивості. Зв'язки у них мають змішаний йонно-ковалентний характер, ступінь окиснення є величиною сталою і дорівнює +3.
У водних розчинах гідратовані катіони Алюмінію
[А1(Н2О)6]3+ і Цинку [Zn(H2O)4]2+ безбарвні, а Хрому(III)
[Сг (Н2О)6]3+ — забарвлені у зелений колір, що й використовують у якісному аналізі.
Арсен, утворює катіони зі ступенями окиснення +3 і +5. Оскільки це амфотерний хімічний елемент, то в лужному середовищі існують аніони оксигено-вмісних кислот AsO33 ˉ і AsO43ˉ(арсеніт-і арсенат-іони), а в кислотному — катіони:
AsO33ˉ ↔ As(OH)3 ↔As3+
Лужне Нейтральне Кислотне
середовище середовище середовище
Отже, визначення Арсену у формі катіонів проводять у сильнокислотному середовищі, а у формі аніонів — у слабко-кислотному, нейтральному або лужному.
Зазначимо, що сполуки Арсену дуже токсичні, тому робота з ними потребує особливої обережності й чіткого дотримання правил техніки безпеки.
Якісні реакції катіонів Zn2+, Cr3+, А13+, As3+. As5+
Реакції катіонів Цинку Zn2+
1*. Реакція з сульфідом натрію або амонію.Натрій сульфід (або амоній сульфід) осаджує з розчинів солей Цинку білий осад ZnS , який розчиняється в хлоридній, але не розчиняється в ацетатній кислоті:
Zn2+ + S2ˉ → ZnS↓
ZnS(T) + 2 НСl = ZnCl2 + H2S ↑.

 Виконання. До 4—5 крапель розчину солі Цинку добавляють таку саму кількість розчину сульфіду натрію або амонію. Спостерігають утворення осаду, який ділять на дві частини. До однієї добавляють хлоридну, до другої — ацетатну кислоту іроблять висновок про розчинність ZnS у кислотах.
Виконання. До 4—5 крапель розчину солі Цинку добавляють таку саму кількість розчину сульфіду натрію або амонію. Спостерігають утворення осаду, який ділять на дві частини. До однієї добавляють хлоридну, до другої — ацетатну кислоту іроблять висновок про розчинність ZnS у кислотах.
2*. Реакція з жовтою кров'яною сіллю. Калій гексаціано-ферат(II) K4[Fe(CN)6] (жовта кров'яна сіль) за наявності солей Цинку утворює білий осад калій-цинк гексаціаноферату(ІІ):
3Zn2++ 2K4[Fe(CN)6] = K2Zn3[Fe(CN)6]2↓ + 6K+.
Ця реакція специфічна, дає змогу відрізнити йони Zn2+ від Аl3+ , причому йони Сг3+ не впливають на перебіг реакції.
Виконання. До 4—5 крапель розчину солі Цинку добавляють таку саму кількість реактиву, перемішують і нагрівають суміш до кипіння. Спостерігають утворення осаду, не розчинного в розбавленій хлоридній кислоті.
3. Реакція з груповим реактивом.Гідроксиди лужних ме
талів осаджують з розчинів солей Цинку білий осад цинк
гідроксиду, який добре розчиняється в надлишку реактиву,
оскільки Zn(OH)2 є типовою амфотерною основою:
Zn2+ + 2 ОH ˉ = Zn (ОН)2 ↓;
Zn(OH)2(T) +2ОН ˉ = [Zn(OH)4]2ˉ .
Виконання. До 4—5 крапель розчину солі Цинку повільно (краплями) добавляють розчин лугу до утворення осаду. Утворений осад ділять на дві частини і досліджують його розчинність у надлишку реактиву та в хлоридній кислоті.
4. Реакціяз дитизоном. Дифенілтіокарбазон (дитизон) ут
ворює з йонами Zn2+ у розчині хлороформу забарвлену внут-
рішньокомплексну сіль — дитизонат цинку:

Реакція характеризується високою чутливістю (0,025 мкг).
Виконання. До 4—5 крапель розчину солі Цинку добавляють кілька крапель хлороформного розчину дитизону і спостерігають забарвлення хлороформного шару в малиново-червоний колір.
Реакції катіонів Хрому Сг3+
5. Реакція з груповим реактивом.їдкі луги NaOH , КОН
осаджують йони Сг3+ у вигляді гідроксиду сіро-зеленого кольору, який має амфотерні властивості:
Сг3+ + ЗОН ˉ → Сг(ОН)3↓;
Сг(ОН)3{т) +ЗОН ˉ → [Сг(ОН)6]3ˉ;
Сг(ОН)3(т)+ЗН+ → Сг3+ + ЗН2О.
Виконання. До 4—5 крапель розчину солі Хрому(Ш) повільно добавляють розчин лугу до утворення осаду. Утворений осад ділять на дві частини і досліджують його розчинність у надлишку реактиву та в хлоридній кислоті.
6. Реакція з амоній сульфідом.Амоній сульфід (NH4)2S
при взаємодії з солями Хрому(Ш) осаджує гідроксид хрому(Ш)
Сг(ОН)3 сіро-зеленого кольору. При цьому виділяється сірководень:
2Сг3+ + ЗS2ˉ + 6H2О → Сг(ОН)3↓ + H2S↑
Виконання. До 4—5 крапель розчину солі Хрому(Ш) добавляють 5—6 крапель розчину амоній сульфіду і трохи нагрівають. Спостерігають утворення осаду Сг(ОН)3.
7. Реакція з сильними окисниками.Сильні окисники (Н2О2, KMnO4, (NH4)2S2O8, Cl2) в лужному середовищі окиснюють йони Сг3+ до хромат-іонів СгО42 ˉ жовтого кольору, а в кислотному середовищі - до дихромат-іонів Сг2О72 ˉ оранжевого кольору.
Окисно-відновні реакції описують такими йонними рівняннями:
2 СгО2ˉ+ З Н2О2 + 2 ОН ˉ → 2 СгО 2 ˉ + 4 Н2О
СгО2ˉ+ 4 ОНˉ - Зе → СгО42ˉ + 2 Н2О 2
Н2О2+2е → 2ОН ˉ 3

|
Mnz+ + 4H2O
Виконання реакції з гідроген пероксидомН2О2. У пробірку вносять 2—3 краплі розчину солі Хрому(Ш) і добавляють 4—5 крапель розчину лугу (до розчинення осаду Сг(ОН)3), 3—4 краплі розчину Н2О2 і трохи нагрівають. Спостерігають перехід забарвлення із зеленого у жовте.
Якщо утворений розчин підкислити сульфатною кислотою, то гідроген пероксид окиснює хромат-іони до пероксиду СгО5 синього кольору:
СгО42 ˉ + 2 Н2О2+2 Н+ = СгО5 + З Н2О.
При добавлянні до цього розчину ефіру і перемішуванні суміші ефірний шар забарвлюється у синій колір.
Виконання реакції з калій перманганатом КМпО4. У фарфорову чашку вносять 5—6 крапель розчину солі Хрому(Ш), кілька крапель 1М розчину H2SO4 і 1 мл розчину КМпО4 . Суміш кип'ятять до переходу малинового забарвлення в оранжеве. Після охолодження до суміші добавляють 2—3 краплі Н2О2, 0,5 мл ефіру і перемішують. Спостерігають забарвлення ефірного шару в синій колір, що пояснюють утворенням пероксиду хрому СгО5 за рівнянням
Сг2О2ˉ + 4 Н2О2 + 2 Н+ → 2 СгО5 + 5 Н2О.
Реакція утворення пероксиду хрому є високочутливою (2,5 мкг) і специфічною.
Реакції катіонів Алюмінію Аl3+
8. Реакція з розчином амоніаку.Водний розчин амоній гідроксиду осаджує з розчинів солей Алюмінію білий аморфний осад алюміній гідроксиду:
Al+3 + 2NH4OH → Al(OH)3↓ + 3NH4+
Алюміній гідроксид Al(OH)3 має амфотерні властивості, отже він легко розчиняється в кислотах та лугах:
Al(OH)3 + 3H+ → Al+3 + 3H2O
Аl(ОН)3(Т) + ОН- = [ А1 (ОН)4 ].
Виконання. До 3—4 крапель розчину солі Алюмінію добавляють 5—6 крапель розчину амоній гідроксиду. Утворений осад ділять на дві частини; до однієї частини добавляють хлоридну кислоту, до другої — розчин лугу. Спостерігають розчинення осаду в обох пробірках.
9. Реакція з груповим реактивом.їдкі луги КОН і NaOH осаджують з розчинів солей Алюмінію білий аморфний осад алюміній гідроксиду:
Al+3 +3OH ˉ → Al(OH)3↓
Утворений осад розчиняється в кислотах і лугах (див. реакцію 8).
Виконання. До 3—4 крапель розчину солі Алюмінію повільно добавляють розчин лугу до утворення осаду. Досліджують його розчинність у кислотах і лугах.
10*. Реакція з кобальт(ІІ) нітратом.Кобальт нітрат при прожарюванні з солями Алюмінію утворює кобальт алюмінат синього кольору, який називають "тенаровою синькою":
2A12(SO4)3 +2Co(NO3)2 → 2Со(А1О2)2 + 4NO2 ↑ +O2 ↑ +6SO3 ↑.
Виконання. У фарфорову чашку вносять 3—4 краплі розчину солі Алюмінію, добавляють таку саму кількість розчину кобальт нітрату. Суміш випарюють і прожарюють до виділення газів. Спостерігають утворення кобальт алюмінату синього кольору.
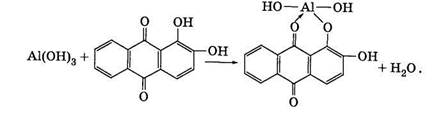
11. Реакція з алізарином.Органічний реактив — 1,2-діок-сіантрахінон (алізарин) утворює з алюміній гідроксидом внут-рішньокомплексну сполуку яскраво-червоного забарвлення, яку називають "алюмінієвим лаком".
Чутливість цієї реакції — 0,5 мкг, її виконують краплинним методом.
Виконання. Кілька крапель розчину солі Алюмінію наносять на смужку фільтрувального паперу, яку впродовж 2—3 хв тримають над концентрованим розчином NH4OH (для утворення А1(ОН)3 за реакцією 8). Потім добавляють кілька крапель спиртового розчину алізарину і знову тримають смужку над випарами амоніаку. Поява червоного забарвлення на фіолетовому фоні підтверджує наявність у досліджуваному розчині йонів А13+ . Рівняння реакції записують так:
|
Реакції катіонів Арсену As3+ і As5+
12. Реакціяз сульфідами.У сильнокислотному середовищі сульфіди при взаємодії з солями Арсену утворюють жовті осади As2S3 або As2S6:
2As3+ + 3S2ˉ=As2S3↓;
2As5+ + 5S2ˉ=As2S5↓;
Арсен(Ш) сульфід не розчинний у концентрованій НС1, він розчиняється в розчинах натрій сульфіду або амоніаку з утворенням тіосолей:
As2S3(T) + 3Na2S = 2Na3AsS3;
Осад As2S5 також розчиняється в надлишку розчину натрій сульфіду, утворюючи розчинну у воді тіосіль за рівнянням
As2S5(T)+3 Na2S = 2 Na3 AsS4.
Виконання. До 4—5 крапель розчину, що містять солі Арсену(III) або Арсену(V), добавляють 2—3 краплі 2М розчину хлоридної кислоти і пропускають у розчин сірководень. Спостерігають утворення жовтого осаду.
13. Реакціяз аргентум нітратом.Розчин AgNO3 утворює з з солями Арсену(Ш) жовтий осад аргентум арсеніту Ag3As03, а з солями Арсену(V) — шоколадно-коричневий осад аргентум арсенату Ag3AsО4:
AsO33ˉ + 3Ag+ → Ag3AsО3↓
AsO43ˉ + 3Ag+ → Ag3AsО4↓
Ця якісна реакція дає можливість розрізнити сполуки Арсену різної валентності.
Виконання. До 4—5 крапель розчину солі арсенітної Na3As03 або арсенатної Na3As04 кислоти добавляють таку саму кількість розчину реактиву і спостерігають утворення осаду, що відрізняється кольором.
14. Реакція з окисниками або відновниками. 1.Розчин йоду (окисник) знебарвлюється солями арсенітної кислоти внаслідок його відновлення до гідроген йодиду за рівнянням
AsO33ˉ + J2 + H2O → AsO3ˉ4+ 2J+ + 2 Н+ .
Виконання. До 4—5 крапель розчину солі Na3AsО3 добавляють невелику кількість твердого натрій гідрогенкарбонату NaHCO3 (для зміщення рівноваги реакції вправо) і після розчинення солі добавляють кілька крапель розчину йоду. Спостерігають знебарвлення розчину йоду.
2. Калій йодид (відновник) унаслідок взаємодії з солями арсенатної кислоти в кислотному середовищі окиснюється до йоду, який забарвлює розчин у жовтий колір:
AsO43ˉ + 2J+ + 2 Н+ → AsO3ˉ3+J2 + Н2О.
Виконання. До 4—5 крапель розчину солі Na3As04 добавляють 3—4 краплі концентрованої НС1 і 0,5 мл бензену. До суміші краплями добавляють розчин калій йодиду і перемішують. Спостерігають забарвлення верхнього прошарку бензену у фіолетовий колір.
15. Реакція Марша.Атомарний водень, що утворюється при взаємодії цинку з сірчаною кислотою, відновлює сполуки Арсену(Ш) і Арсену(У) до арсину AsH3. Утворений газ легко розкладається з утворенням Арсену, який виявляють за допомогою розчину AgNO3:
AsO33ˉ + 3Zn + 9H+ = AsH3 ↑ + 3Zn2+ + 3H2O;
AsO43ˉ + 4Zn + 11H+ =AsH3↑+ 4Zn2+ + 4H2O;
2AsH → t 2As + 3H
Реакція високочутлива і дає змогу виявити навіть незначні кількості сполук Арсену в біоматеріалі.
Виконання. У пробірку вносять 2—3 мл сульфатної кислоти, додають кілька кусочків металічного цинку і 3—4 краплі
досліджуваного розчину. У верхню частину пробірки вставляють ватний тампон, просочений розчином плюмбум ацетату (для того, щоб зв'язати можливі домішки сірководню H2S). Отвір пробірки накривають фільтрувальним папером, змоченим розчином AgNO3. За наявності в розчині сполук Арсену на фільтрувальному папері появляється бура або чорна пляма. Оскільки AsH3 дуже отруйний, то цей дослід проводять у витяжній шафі
|
Читайте також:
- CMM. Групи ключових процесів
- I. Загальна характеристика політичної та правової думки античної Греції.
- II. ВИРОБНИЧА ХАРАКТЕРИСТИКА ПРОФЕСІЇ
- II. Морфофункціональна характеристика відділів головного мозку
- IV. Загальна оцінка діяльності вчителя
- IV. Загальна схема поточного і підсумкового контролю та оцінювання знань студентів
- Ni - загальна кількість періодів, протягом яких діє процентна ставка ri.
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Автобіографія. Резюме. Характеристика. Рекомендаційний лист
- Автокореляційна характеристика системи
- Агровиробничі групи грунтів України
- Алгоритм вибору групи ЛП для самолікування діареї
| <== попередня сторінка | | | наступна сторінка ==> |
| Забарвлення полум’я. | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |