
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Загальна характеристика групи
До складу катіонів п'ятої аналітичної групи входять металічні елементи Fe2+ , Fe3+ , Mn2+ , Mg2+ , а також катіони р-еле-ментів Ві3+ , Sb3+ і Sb5+ . Розглянемо тільки перших чотири катіони, що пов'язано з їх біологічним значенням і потребою визначення в клінічних, біохімічних та контрольно-аналітичних лабораторіях.
Груповим реактивом катіонів п'ятої аналітичної групи є сильні основи NaOH , КОН, які утворюють з ними гідроксиди, що належать до слабких основ, не розчинних у воді, амоніаку й лугах. Проте вони добре розчиняються в кислотах і, на відміну від катіонів четвертої аналітичної групи, не розчиняються в надлишку лугів, оскільки не мають амфотерних властивостей.
Елементи, що утворюють катіони цієї аналітичної групи, перебувають у різних групах ПСЕ і тому мають дещо відмінні фізико-хімічні властивості. Якщо Ферум і Манган належать до родини d-елементів, то Магній — це s-елемент ІІА групи. Відомо, що d-елементи мають незавершену передостанню атомну орбіталь і тому виявляють змінну валентність, а відповідно, й різні ступені окиснення. Ферум у сполуках виявляє ступені окиснення +2, +3, +6, а Манган утворює сполуки зі с. о. +2,- +3, +4, +6, +7. Як і для інших d-елементів, зі збільшенням ступеня окиснення елемента основні властивості оксидів і гідроксидів Феруму й Мангану послаблюються, а кислотні - посилюються (табл. ).
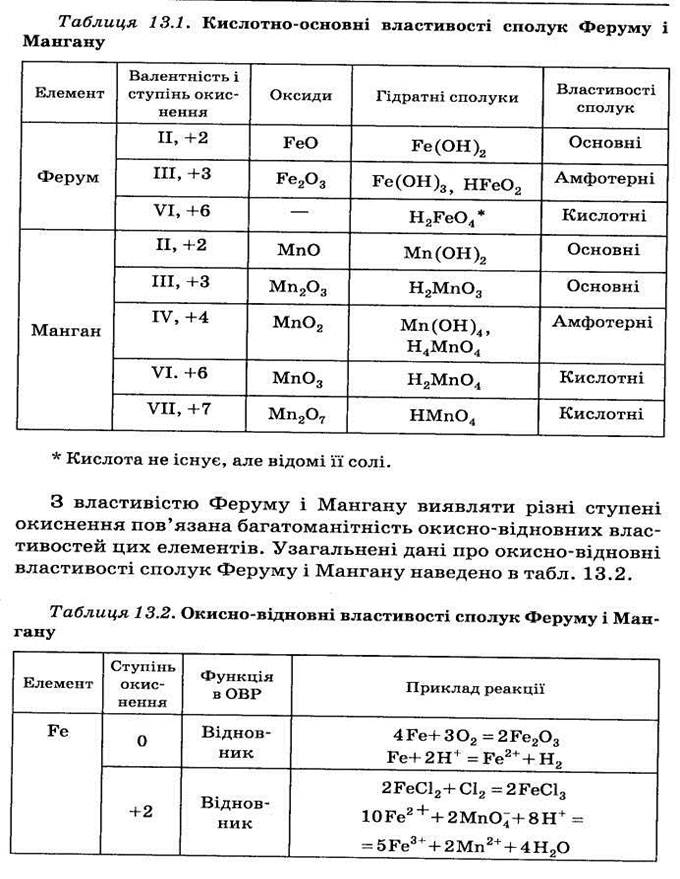
|

|
Зазначимо, що для катіонів Fe2+ і Мп2+ характерні реакції утворення комплексних сполук з координаційним числом, яке здебільшого дорівнює 6 і рідше 4.
У водних розчинах йони перехідних елементів, що мають незавершену d-орбіталь, забарвлені, наприклад Fe3+ — темно-коричневий, Fe2+ — сіро-зелений, йон МпО4 — фіолетовий.
Якісні реакції катіонів Mg2+, Fe2+, Fe3+, Mn2+
Реакції катіонів Магнію Мп2+
1*. Реакція з натрій гідрогенфосфатом.Натрій гідроген-фосфат Na2HPO4 за наявності амоній гідроксиду і амоній хлориду утворює з йонами Магнію білий кристалічний осад подвійної солі магній-амоній фосфату:
Mg2+ + NH4OH + Na2HPO4 → MgNH4PO4↓ + 2Na+ + Н2О.
Сіль NH4C1 добавляють для того, щоб при дії NH4OH запобігти утворенню малорозчинного осаду Mg(OH)2.
Ця реакція досить чутлива (10 мкг), її використовують для визначення йонів Mg2+ у крові.
Виконання. У пробірку вносять 2—3 краплі солі Магнію, добавляють 2 краплі розчину амоній гідроксиду і розчину амоній хлориду до повного розчинення осаду Mg(OH)2. До суміші добавляють при перемішуванні розчин Na2HPO4. Випробовують розчинення осаду в мінеральних та в ацетатній кислотах, у яких він добре розчиняється.
2. Реакція з гідроксидами лужних металів.Сильні луги осаджують
з розчинів солей Магнію білий аморфний осад магній гідроксиду:
Mg2+ + 2 ОН ˉ= Mg(OH)2 ↓ .
Цю реакцію можна використати для відокремлення йонів Mg2+ від йонів К+ і Na+ , оскільки гідроксиди лужних металів добре розчиняються у воді.
Виконання. У пробірку вносять 2—3 краплі солі Магнію і стільки ж розчину лугу. Спостерігають утворення осаду, який розчиняється в мінеральних кислотах і солях амонію (див. рівняння реакції в п. 13.1).
3. Реакція з амоній гідроксидом.Розчин амоній гідроксиду
утворює з йонами Магнію білий осад магній гідроксиду:
Mg2+ + 2NH4OH → Mg(OH)2↓+ 2NH3↑.
Цей процес є оборотним, тому за наявності в розчині солей амонію рівновага зміщується вліво і осад Mg (OH)2 може не утворюватись.
Виконання. У дві пробірки вносять по 2—3 краплі солі Магнію. У першу доливають трохи амоній хлориду і в обидві пробірки вносять по кілька крапель розчину NH4OH . Переконуються в тому, що амоній гідроксид за наявності солей амонію не осаджує катіони Mg2+ .
4. Реакція з оксихіноліном.Цей органічний реагент утворює з солями
Магнію жовто-зелений кристалічний осад магнійоксихіноляту Mg(Ox)2 за схемою

|
Ця реакція характеризується високою чутливістю (0,25 мкг), однак для виявлення катіонів Магнію її можна використати тільки після відокремлення йонів Са2+, Ва2+ і Sr2+ , з якими оксихінолін також утворює забарвлені комплексні сполуки.
Виконання. До 2—3 крапель солі Магнію добавляють по дві краплі NH4OH і NH4C1 і стільки ж спиртового розчину 8-ок-сихіноліну. Спостерігають утворення осаду.
Реакції катіонів Феруму(ІІ) Fe2+
5*. Реакція з червоною кров'яноюсіллю. Калій гекса-ціаноферат(Ш) K3[Fe(CN)6] (червона кров'яна сіль) утворює з йонами Fe2+ темно-синій осад, який дістав назву "турнбулентової сині
FeSO4 + К3[Fе(СN)6] = KFe[Fe(CN)6]↓ + K2SO4
а потім утворені йони Fe3+ сполучаються з аніоном гекса-ціаноферату(П), утворюючи нерозчинну комплексну сполуку за рівнянням
Fe3+ + К+ + [Fe+2 (CN)6]4ˉ = KFe+3 [Fe+2 (CN)6] Отже, за складом ця сполука ідентична берлінській блакиті
Наведена якісна реакція характеризується високою чутливістю (0,05 мкг), її виконують у кислотному середовищі.
Виконання. До 3—4 крапель солі двовалентного Феруму добавляють 2—3 краплі хлоридної кислоти (для призупинення гідролізу солі) і 2—3 краплі реактиву. До утвореного темно-синього осаду добавляють трохи розчину лугу і спостерігають зміну забарвлення, пов'язану з руйнуванням комплексу та утворенням ферум(П) гідроксиду.
6. Реакція з амоній сульфідом.Амоній сульфід (NH4 )2 S утворює з солями Fe(II) чорний осад ферум(П) сульфіду:
Fe2+ + S2ˉ=FeS↓.
Осад розчиняється в розбавлених мінеральних кислотах.
Виконання. До 3—4 крапель солі Феруму(П) добавляють 2—3 краплі розчину реактиву. Приливають трохи хлоридної кислоти і спостерігають розчинення осаду.
Реакції катіонів заліза(ІІІ) Реакція з гексаціанофератом(II) калію.Гексаціаноферат (II) калію K4[Fe(CN)6] у слабокислому середовищі утворює з Fe3+темно-синій осад, який має тривіальну назву “берлінська лазур”:
Fe3+ + K+ + [Fe(CN)6]4ˉ = K Fe [Fe(CN)6]↓
За даними рентгеноструктурних досліджень берлінська лазур ідентична з турн-булевою синню, яка утворюється при реакції Fe2+ із K3[Fe(CN)6].
Реакція специфічна. Проведенню реакції заважають окислювачі, які здатні окислити реагент K4[Fe(CN)6] до K3[Fe(CN)6]. (див. "Реакції катіонів заліза(ІІ)).
Реакція з тіоціанатом (роданідом) амонію. Солі Fe3+ утворюють з тіоціо-нат-іоном комплексну сполуку, забарвлену в червоний колір:
Fe3+ + 3SCNˉ = [Fe(SCN)3]
При надлишку реагенту утворюються комплексні іони змінного складу: [Fe(SCN)4]ˉ , [Fe(SCN)5]2ˉ, [Fe(SCN)6]3ˉ. Виконувати реакцію належить в кислому середовищі (рН ≈ 2). Чутливість реакції 0,25мкг. Заважають відкриттю іони NO2 (утворюють із SCNˉ сполуку NOSCN червоного кольору), а також ті іони, які утворюють із залізом (ІІІ) більш стійкі безбарвні сполуки, наприклад:
[Fe(SCN)3] + 6Fˉ = [FeF6]3ˉ + 3SCNˉ
Реакція із сульфідом натрію.Сульфід натрію Na2S осаджує з розчинів солей заліза (III) Fe2S3 чорного кольору:
2Fe3+ + 3S2ˉ = Fe2S3↓
Fe2S3 розчиняється в мінеральних кислотах:
Fe2S3↓ + 6HCl = 2FeCl3 + 3H2S↑
Fe2S3↓ + 6H+ = 2Fe3+ + 3H2S
Читайте також:
- CMM. Групи ключових процесів
- I. Загальна характеристика політичної та правової думки античної Греції.
- II. ВИРОБНИЧА ХАРАКТЕРИСТИКА ПРОФЕСІЇ
- II. Морфофункціональна характеристика відділів головного мозку
- IV. Загальна оцінка діяльності вчителя
- IV. Загальна схема поточного і підсумкового контролю та оцінювання знань студентів
- Ni - загальна кількість періодів, протягом яких діє процентна ставка ri.
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Автобіографія. Резюме. Характеристика. Рекомендаційний лист
- Автокореляційна характеристика системи
- Агровиробничі групи грунтів України
- Алгоритм вибору групи ЛП для самолікування діареї
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Реакції катіонів мангану (марганцю) |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |