
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
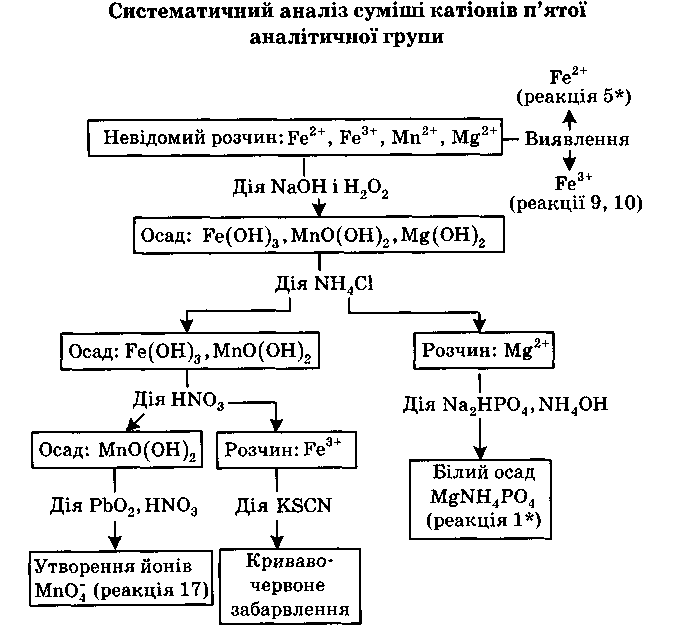
Реакція іонів стибію(III) і стибію (V) (сурми)
Реакції гідролізу при розбавленні розчинів.Солі сурми (III) у слабокис-лих розчинах при додаванні великої кількості води легко гідролізують, утворю-ючи білий осад SbOCl:
H3[SbCl6] + Н2O = SbOCI↓+ 5НС1
Винна кислота заважає процесу гідролізу, бо взаємодіє із солями сурми (III) з утворенням розчинної комплексної сполуки:
SbOCI↓ + H2C4H4O6 = [SbOHC4H4O6] + НС1
При гідролізі солей сурми (V) виділяється білий осад основної солі сурми (V), розчинний у НС1:
H[SbCl6] + 2H2O = SbO2Cl↓ + 5НС1
Реакція з тіосульфатом натрію.Тіосульфат натрію утворює в кислих розчинах із солями сурми (III) осад сульфіду сурми оранжево-червоного кольо-ру:
2H3[SbCl6] + 3Na2S2O3 + 3Н2O = Sb2S3↓ + 12HC1 + 3Na2SO4
Проведенню реакції заважають іони Bi3+, які утворюють осад Bi2S3 чорного ко-льору.
Реакція з сірководнем. Сірководень утворює із солями сурми у кислому сере-довищі оранжево-червоні осади Sb2S3 і Sb2S5.
2H3[SbCl6] + 3Н2S = Sb2S3↓ + 12HCl
2H[SbCl6] + 5Н2S = Sb2S5↓ + 12HCl
Осади розчинні в розчинах сульфідів амонію і лужних металів з утворенням тіо-солей:
Sb2S3↓ + 3Na2S = 2Na3SbS3
Sb2S5↓ + 3Na2S = 2Na3SbS4
Тіосолі сурми розкладаються під дією кислот, утворюючи сульфіди сурми.
Реакції відновлення. Іони сурми (III) і сурми (V) у кислому середовищі від-новлюються металами, що знаходяться лівіше від сурми в ряді напруг (Zn, Fe, А1) до металічної сурми. Так, наприклад, цинкова платівка чорніє від того, що на поверхні утворюється металічна сурма:
2H3[SbCl6] + 3Zn = 2Sb↓ + 3ZnCl2 + 6HCl
Крім описаних вище реакцій іони сурми (III) дають також реакції: із 8-оксихіноліном і KI (жовтий осад [SbI4]Ox)], фосфорномолібденовою кислотою (утворення молібденової сині).
|
Читайте також:
- I група катіонів
- II група катіонів
- IV група катіонів
- V група катіонів
- V Ідентифікація, раціоналізація, проекція, інтроекція, агресія, зворотна реакція та їх комплекси.
- VI група катіонів
- VI Реакція вуглеводневого адикалу
- VІ – харчова реакція (пиття).
- А — позитивна умовна реакція натискання на клавішу, В — бурхлива емоційно-рухова реакція за відсутності харчового підкріплення сигналу.
- АНАЛІЗ АНІОНІВ
- Аналіз регіонів щодо інвестицій.
- Антропогенні впливи та реакція геосистем на них
| <== попередня сторінка | | | наступна сторінка ==> |
| Реакції катіонів мангану (марганцю) | | | Катіони шостої аналітичної групи |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |