
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тема 2. Будова атома
Згідно з сучасними поглядами, атоми - частинки діаметром близько кількох ангстрем: n ´ 10-10 м (1 А = 1´ 10-10 м; 1 нм = 1´ 10-9 м)
Маса атомів коливається від n ´ 10-27 до n ´ 10-25 кг.
Атоми складаються з ядра і електронів, що рухаються на деяких відстанях від ядра. Діаметр ядра ~ 10-15 - 10-14 м. Тобто ядро у 10-10/10-15 = 105 разів менше, ніж атом.
Ядро атома складається із протонів і нейтронів (загальна назва - нуклони).
Протон (р)- це елементарна частинка з масою mр = 1,672 ´ 10-27 кг, або 1,0073 а.о.м., і позитивним зарядом q = 1,602 ´ 10-19 Кл (який приймають за одну відносну одиницю заряду + 1).
Нейтрон (n)- незаряджена частинка з масою mn = 1,674 ´ 10-27 кг, тобто 1,0087 а.о.м.
Сума числа протонів (Z) і числа нейтронів (N) називається нуклонним числом (масовим числом).
Найважливішою часткою в хімії є електрон (е). За допомогою валентних електронів утворюються хімічні зв’язки. А суттю хімічних реакцій є руйнування одних та утворення інших хімічних зв’язків. Електрон це частинка з масою покою 9,110 × 10 –31 кг (що складає 1/1836 маси протона) і негативним зарядом, абсолютне значення якого дорівнює 1,602 × 10 –19 Кл. Електрон має двоїсту природу – властивості частки та хвилі. Електрон в атомі спрощено уявляють як хмару з певною густиною негативного електричного заряду в певному об’ємі простору навколо ядра (електронна орбіталь).
Електрони в атомі характеризуються чотирма квантовими числами.
Головне квантове число (n)-характеризує енергію електрона на енергетичному рівні і пріймає значення: n = 1,2, 3,.... .
Орбітальне квантове число (l) - визначає форму орбіталі, пріймає значення: l = 0,1,2,... (n-1) і енергію електрона на енергетичному підрівні.
Орбіталі можуть мати форму кулі (s-орбіталі, l=0), гантелі (р-орбіталі, l=1) (див. рисунок 1), або більш складної форми (d-, f- l=2 та 3 відповідно).
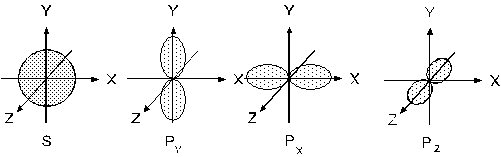
Рис.1. Форми s і р – електронних орбіталей.
Магнітне квантове число (m) - визначає орієнтацію орбіталі в просторі: m = – l,–( l –1),....–1,0,1,....( l –1), l.
Спінове квантове число - (s) - характеризує власний магнітний момент електрона: s = +1/2; –1/2.
Для визначення електронних конфігурацій атомів слід використовувати такі правила.
Принцип Паулі: в атомі не може бути двох електронів з однаковими значеннями всіх чотирьох квантових чисел.
Правило Гунда сумарний спін електронів не повністю заповненого підрівня має бути максимальним.
Правило Клєчковського: електрони заповнюють енергетичні підрівні в порядку зростання енергії, яка характеризується сумою (n+l), якщо ця сума однакова, спочатку заповнюється підрівень з меншим n.
Послідовність заповнення електронами підрівнів:1s,2s,2p,3s,3p,4s, 3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d,7p.
Електронна конфігурація атома визначає хімічні властивості елементів.
Для з’ясування кількості неспарених електронів використовують електронно-графічні формули, які показують розміщення електронів на атомних орбіталях, що зображуються за допомогою комірок. Наприклад, електронно-графічна формула атому Оксигену:
 |
2p
2s
1s
Рис.2. Електроно-графічна схема атома Оксигену.
Приклад 6.
Складіть електронну формулу елемента з порядковим номером 41. Скільки неспарених електронів має атом цього елемента?
Розв'язання.
Nb 1s22s22p63s23p64s23d104p65s24d3.
Усі підрівні, крім 4d, заповнені повністю, тому неспарені електрони можуть бути тільки на 4d підрівні. Розміщення електронів в межах підрівня здійснюється згідно з правилом Гунда, тобто всього в атомі Nb 3 неспарених електрони (рис.3)
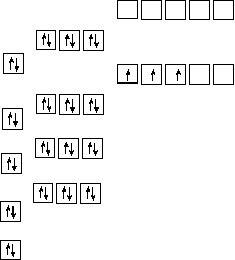
s p d
Рис.3. Електроно-графічна формула атома Ніобія.
Приклад 7.
Закінчити рівняння ядерного перетворення:  . Ізотоп якого елемента утворюється при цьому, скількі протонів та нейтронів міститься в його ядрі?
. Ізотоп якого елемента утворюється при цьому, скількі протонів та нейтронів міститься в його ядрі?
Розвязання.
Під час ядерних перетворень виконуються закони збереження заряду і маси. Заряди атомів приведені в лівому нижньому куті від символу елемента, а нуклонні (масові) числа – у верхньому лівому куті.
Нуклонне число невідомого елемента дорівнює: 98 +2 – 1= 99, а його заряд: 42 + 1 – 0 = 43.
Заряд ядра визначає елемент. Елемент з порядковим номером 43 – це Технецій:

Кількість протонів дорівнює заряду ядра – 43, кількість нейтронів – різниці між нуклонним числом і зарядом ядра: 99 – 43 = 56.
Запитання для самоконтролю
1. В чому суть корпускулярно-хвильової природи електрона?
2. З яких часток складається атом?
3. Які розміри мають ядра атомів та самі атоми?
4. Які елементарні частки ви знаєте?
5. Що таке ізотопи?
6. Які види радіоактивності ви знаєте?
7. За допомогою яких квантових чисел описують поведінку електронів?
8. Як складаються електронні формули?
9. Сформулюйте принцип Паулі.
10. Сформулюйте правило Гунда.
Читайте також:
- C. 3. Структурна побудова управління організаціями.
- II. Будова доменної печі (ДП) і її робота
- Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями.
- Анатомічна будова кістки
- Анатомічна будова кісток вільної нижньої кінцівки
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка та її вплив на його психологічні особливості й поведінку.
- Антигенна будова HDV
- АСОЦІАЦІЯ. ПОБУДОВА АСОЦІАТИВНОГО КУЩА
- Атмосфера. ЇЇ хімічний склад та будова
- Атомарний рівень будови речовини
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Тема 3. Періодичний закон |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |