
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Способи вираження складу розчинів.
Масова частка — це відношення маси розчиненої (речовини (m1) до маси розчину (Smi) :

Масову частку виражають у частках одиниці або у відсотках (0,5 або 50 %) і позначають літерою w - омега.
Мольна частка (N1) – це відношення кількості розчиненої речовини (n1)до суми кількостей всіх речовин у розчині (Sni).
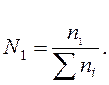
Молярна концентрація (С) — це відношення кількості розчиненої речовини (n1) до об'єму розчину (V). Молярність виражають у молях на літр (скорочено М).
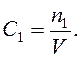
Молярна концентрація еквівалента (Секв ) — це відношення кількості молей еквівалента розчиненої речовини (nекв) до об'єму розчину.
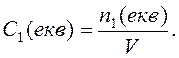
Моляльність (Сm) – число молей розчиненої речовини (n1 ), що міститься в 1000 г розчинника.
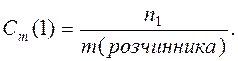
Приклад 21.
Визначте масову долю нітратної кислоти в розчині, 1 л якого містить 224 г HNO3, густина розчину 1,12 г/мл.
Розв'язання.
Маса розчину: m = r V = 1,12 г/мл 1000 мл = 1120 г.
Масова доля розчиненої речовини буде: 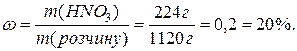
Приклад 22.
Визначити молярну концентрацію фосфатної кислоти в розчині з масовою часткою її 47,7%, густина розчину дорівнює 1.315 г/мл.
Розв'язання.
В 100 г розчину знаходяться 47,7 г Н3РО4 і 53,3 г Н2О.
Об’єм розчину дорівнює: V = m/r = 100г / 1,315г/мл = 76 мл.
Молярна концентрація буде:
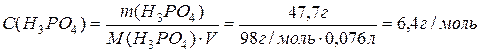
Речовини, які розкладаються в розчині на іони, називаються електролітами. Речовини, які не розкладаються на іони, називаються неелектролітами. Процес розпаду речовин на іони називається електролітичною дисоціацією. Позитивно заряджені іони називаються катіонами, негативно заряджені – аніонами.
Кількісною характеристикою повноти перебігу електролітичної дисоціації є ступінь дисоціації a, яка дорівнює відношенню числа молекул електроліту, що розщепились у розчині на іони, до загального числа молекул у розчині. Ступінь дисоціації виражається дробовим числом і змінюється від 0 до 1 (0 ... 100 %). За величиною ступеня дисоціації електроліти поділяють на сильні та слабкі. Сильними є електроліти, ступінь дисоціації яких у 0,1 М водному розчині перевищує 30%, слабкими — ступінь дисоціації яких у 0,1 М водному розчині менший за 3%. До сильних електролітів належать майже всі солі, луги, деякі кислоти (НСl, НClo4 НNО3, Н2SО4 тощо), до слабких — більшість основ, амфотерні гідроксиди, деякі кислоти (H2S, Н3ВО3, HCN, Н2SiО3 , H2CO3, НNО2, Н2SО3 тощо).
Більш зручною характеристикою сили електроліту є константа дисоціації. Для електроліту КА, який дисоціює згідно з рівнянням:
КА = К+ + А–,
константа дисоціації запишеться:
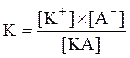 .
.
Константа і ступінь дисоціації пов’язані рівнянням Освальда:
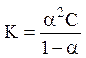 ,
,
де С – загальна концентрація електроліту.
Константа дисоціації залежить від природи електроліту, температури, розчинника, але не залежить від концентрації електроліту.
Приклад 23.
Розрахуйте концентрацію іонів в розчині сульфату натрію, концентрація якого складає 1 моль/л.
Розв'язання.
Оскількі ця сіль є сильним електролітом, то вона дисоціює повністю:
Na2SO4 = 2Na+ + SO42–.
З рівняння дисоціації маємо:
[Na+] = 2 C(Na2SO4) = 2 1= 2 моль/л. [SO42–] = C(Na2SO4) = 1моль/л.
Приклад 24.
Концентрація ціанід–іонів в 1 М розчині синильної (ціанідної) кислоти дорівнює 2 10–5 моль/л. Визначте ступінь і константу дисоціації кислоти.
Розв'язання.
Рівняння дисоціації має вигляд: HCN = H+ + CN–.
Ступінь дисоціації визначається за формулою: a = Сіонів/Сзагальне = 2 10–5/ 1 = 2 10–5.
Згідно з рівніння Освальда:
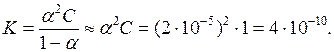
Закон Рауля:
відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольній частці розчиненої речовини.
(р0 – р1) / р0 = N2,
Другий варіант формулювання закону Рауля:
Читайте також:
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- II.3. Основні способи і прийоми досягнення адекватності
- III. Вимоги до учасників, складу груп і керівників туристських подорожей
- III. Вимоги до учасників, складу груп і керівників туристських подорожей
- Адаптація особового складу до служби
- Активні інгредієнти, що входять до складу препаратів для симптоматичного лікування лихоманки.
- Активні інгредієнти, що входять до складу препаратів для симптоматичного лікування сухого кашлю.
- Аналіз показників складу, структури й технічного стану основних фондів.
- Аналіз складу газів
- Аналіз складу і структури фінансових результатів підприємства
- Аналіз складу й динаміки балансового прибутку
- Аналіз складу кредитного портфеля банку і оцінка його якості.
| <== попередня сторінка | | | наступна сторінка ==> |
| Фазова рівновага | | | Тиск насиченої пари над розчином дорівнює добутку його тиску над чистим розчинником на мольну частку розчинника. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |