
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тема 10. Окисно–відновні процеси
Окисно-відновними реакціями називаються реакції, що протікають із зміною ступеня окиснення елементів, які входять до складу реагуючих речовин.
Cтупінь окиснення – це умовний заряд атома в молекулі, розрахований виходячи з припущення, що молекула складається з іонів.
Правило для розрахунків ступеня окиснення – алгебраїчна сума ступенів окиснення атомів в молекулі дорівнює нулю.Для розрахунків ступенів окиснення якогось атома в молекулі треба знати всі ступені окиснення елементів, крім одного. Для практичних розрахунків треба знати ступені окиснення елементів, які мають (в більшості випадків) сталі ступені окиснення:
–1 F
–2 O (крім пероксидів, в яких ступінь окинення дорівнює –1)
+1 лужні метали, гідроген (крім гідридів, в яких ступінь окиснення гідрогену дорівнює –1)
+2 лужноземельні метали.
Треба мати на увазі, що ступені окиснення простих речовин прийняті рівними 0.
Приклад 33.
Розрахувати ступінь окиснення хрому в сполуці K2Cr2O7.
Розв'язання.
Ступені окиснення К та О дорівнюють відповідно +1 та –2. Враховуючи, що алгебраїчна сума ступенів окиснення атомів в молекулі дорівнює нулю, складемо рівняння: 2×(+1) + 2×х + 7×(–2) = 0; х = +6.
Окиснення – це процес віддачі електронів часткою, а відновлення – приєднання електронів. Частки, які віддають електрони, є відновниками, в процесі реакції вони окислюються ( ступінь окиснення їх підвищується). Частки, які приєднують електрони, є окисниками, під час реакції вони відновлюються ( ступінь окиснення знижується).
За механізмом перебігу розрізняють: міжмолекулярні, внутрішньомолекулярні та реакції диспропорціонування.
Міжмолекулярні - це реакції, в яких окисник і відновник є різними речовинами.
У внутрішньомолекулярних реакціях зміна ступеню окиснення атомів відбувається в одній молекулі.
У реакціях диспропорціонування окисником і відновником є атоми того самого елемента.
Метод електронного балансу.
За цим методом складають електронні рівняння, в яких вказуються ступені окиснення, а також число відданих та прийнятих електронів. Кількість відданих електронів має дорівнювати кількості приєднаних електронів.
Приклад 34.
Встановити коефіцієнти в рівнянні:
KMnO4 + H3PO3 + H2SO4 ® MnSO4 + H3PO4 + K2SO4 + H2O
Розв'зання.
По-перше,треба визначити ступені окиснення елементів:

Ступінь окиснення змінюється у атомів Mn i P. Ці зміни можна виразити електронними рівняннями:
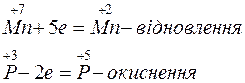
Кількість відданих електронів повинна дорівнювати кількості прийнятих електронів. Для цього першу реакцію треба помножити на 2, другу - на 5 ( +10 е та –10 е ). Вносимо ці коефіцієнти в рівняння реакції. Коефіцієнти перед речовинами, атоми яких не змінюють ступінь окиснення, знаходимо шляхом підбору:
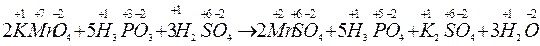
Під час складання рівнянь окисно–відновних реакцій методом електронного балансу слід дотримуватись такої послідовності дій:
– скласти схему рівняння реакції і зазначити вихідні речовини і продукти реакції;
– визначити ступені окиснення всіх елементів, виділити елементи, ступені окиснення яких змінюються;
– скласти електронні рівняння;
– підібрати найменші коефіцієнти, на які треба помножити електронні рівняння, щоб кількість електронів, що віддана, дорівнювала кількості електронів, що приєднана (електронний баланс):
– підібрані коефіцієнти поставити в молекулярному рівнянні поперед формулами відповідних сполук;
– підібрати коефіцієнти біля формул сполук, які не змінюють своїх ступенів окиснення.
Реакція горіння є типовою окисно-відновною реакцією. Кисень повітря в цій реакції виступає в якості окисника, а горюча речовина – в якості відновника.
Контакт окисника та відновника може призвести до хімічної реакції між ними. За деяких умов така реакція може відбуватися у вигляді процесу горіння або вибуху. Особливістю реакцій між сильними окисниками та відновниками є те, що процес горіння може початися за відсутності джерела запалювання, лише через тепловиділення внаслідок хімічної реакції. Такий процес назвається самозайманням. Так, контакт концентрованої азотної кислоти з багатьма органічними речовинами призводить до самозаймання. До такого ж ефекту призводить контакт твердого перманганату калію зі спиртами, альдегідами та карбоновими кислотами. Ні азотна кислота, ні перманганат калію за звичайних умов не здатні горіти (негорючі речовини), але, як можна побачити з наведених прикладів, обидві ці речовини є пожежонебезпечними.
Запитання до самоконтролю
1. Які реакції називаються окисно-відновними?
2. Який процес називається окисненням, а який відновленням?
3. Що таке окисник і відновник?
4. Що таке ступінь окиснення?
5. Які є типи окисно-відновних реакцій?
6. У чому полягає суть методу електронного балансу?
7. Яка речовина є окисником в реакціях горіння в повітрі?
Читайте також:
- V Практично всі психічні процеси роблять свій внесок в специфіку організації свідомості та самосвідомості.
- Блок 1. Соціально-демографічні та міграційні процеси.
- Важелі впливу на процеси розвитку ринку капіталу.
- Виділяються три ключові процеси, що дають змогу вирішувати задачі організаційних змін.
- Виробничий, технологічний і трудовий процеси
- Виробничий, технологічний процеси і їх елементи
- Виробничі процеси, їх класифікація і принципи організації
- ВИРОБНИЧІ СИСТЕМИ І ПРОЦЕСИ
- Вплив нового зовнішньополітичного мислення, американо-радянського співробітництва на світові процеси
- Вплив опромінення на процеси старіння
- Вплив рослин та тваринних організмів на процеси переносу
- Вплив світових фінансових криз на процеси глобалізації.
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 9. Колоїдні системи | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |