
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічні властивості Карбону та Силіцію
Карбон і Силіцій відносяться до головної підгрупи четвертої групи періодичної системи елементів. Більшість сполук карбону вивчаються в розділі “Органічна хімія”, до неорганічних сполук традиційно відносять оксиди Карбону (СО – чадний газ, СО2 - вуглекислий газ), карбонатну (вугільну) кислоту та її солі, а також сполуки карбону з металами – карбіди. Відомі також неорганічні сполуки вуглецю – карбоніли.
Карбон утворює декілька алотропних модифікацій: алмаз, графіт, карбін і полікумулен, з яких найбільш поширеною є графіт. Часто зустрічається також аморфний вуглець. Вуглець за звичайних умов – малоактивна речовина, але його активність значно підвищується із зростанням температури. З різних модифікацій Карбону найактивнішою є аморфна, менш активним є графіт і ще менш активним – алмаз.
При спалюванні вугілля, основною складовою частиною якого є карбон, відбувається реакція:
С+ О2 = СО2.
Вуглець також безпосередньо реагує із флуором і при сильному нагріванні за присутності каталізатора з воднем:
С + 2F2 = СF4 , С + 2H2 = СH4.
Ступінь окиснення Карбону в його сполуках буває: –4, +2, +4. Карбон в неорганічних сполуках може знаходитися в таких станах гібридизації: sp, sp2, sp3, яким відповідає координаційне число, відповідно, 2, 3, 4.
Оксид Карбону (ІІ) (чадний газ) – безбарвний газ без запаху, дуже отруйний. Він може утворюватися під час пожежі в умовах недостатньої кількості кисню. Чадний газ не поглинається у звичайних протигазах, що викликає потребу використовувати ізолюючі протигази. СО – за підвищених температур сильний відновник, що використовується в металургійних процесах:
Fe2O3 + 3CO = 2Fe + 3CO2 .
Оксид карбону (ІV) (вуглекислий газ) – безбарвний газ із слабким кислуватим запахом, не підтримує горіння та дихання. Велика кількість вуглекислого газу небезпечна для людського організму: вже через наявність 7% СО2 у повітрі людина непритомніє, а за наявності 20% СО2 наступає параліч органів дихання. Вуглекислий газ є більш ефективним флегматизатором, ніж азот і аргон, тому його використовують як газовий засіб пожежогасіння у вогнегасниках типу ВВ (російська абревіатура ОУ). В цих вогнегасниках СО2 під тиском 5-20 МПа переходить в рідкий стан. Під час роботи вогнегасника вуглекислий газ, що виходить під тиском з вогнегасника, завдяки інтенсивному випаровуванню та розширенню, охолоджується і частково переходить у твердий стан (сухий лід). Він припиняє доступ повітря до осередку загоряння і одночасно охолоджує його, це приводить до припинення процесу горіння. Але найбільш активні метали можуть горіти у вуглекислому газі:
2Mg + CO2 = 2MgO + C.
Тому СО2 не можна використовувати для гасіння таких металів.
При взаємодії СО2 з водою утворюється слабка і нестійка двохосновна карбонатна (вугільна) кислота - Н2СО3. Солі карбонатної кислоти – карбонати – в більшості не розчинені у воді (крім солей лужних металів та амонію). Нерозчинені у воді карбонати при нагріванні розкладаються на вуглекислий газ та оксид металу:
СаСО3 = СаО + СО2.
Ця реакція використовується для добування негашеного вапна (СаО). При взаємодії його з водою (процес гасіння) одержують гашене вапно:
СаО + Н2О = Са(ОН)2 .
Дрібний гідрокарбонат натрію є основою вогнегасного порошку - ПСБ-3. Водний розчин NaНCO3 є основою лужної складової в хімічно-пінних вогнегасниках. Кислотна складова хімічно-пінних вогнегасників складається з сульфатної кислоти або її суміші з сульфатом феруму. При роботі таких вогнегасників використовується газоутворююча реакція:
2NaНCO3 + H2SO4 = Na2SO4 + H2O + CO2.
З металами Карбон утворює карбіди, які утворюються при сильному нагріванні вуглецю з металами або оксидами металів:
СаО +3С = СО + СаС2 , 4Аl + 3C = Al4C3.
Під час взаємодії карбідів з водою утворюються відповідні гідроксиди і вуглеводні:
СаС2+ Н2О = Са(ОН)2 + С2Н2, Al4C3 + 12Н2О=4Аl(ОН)3 +3СН4.
Виділення горючих газів при взаємодії з водою робить карбіди пожежонебезпечними. Крім того, при гасінні карбідів не можна використовувати воду. При взаємодії карбідів активних металів з водою вуглеводні, що виділяються, можуть займатися за звичайних умов.
Силіцій є другим за поширеністю елементом земної кори (26,7%). Основними ступінями окиснення Силіцію є +4 і –4. Ступінь окиснення –4 Силіцій має у сполуках з металами (силіциди) та гідрогеном (силани). Силіциди утворюються за високих температур при взаємодії простих речовин або оксидів металів з кремнієм:
2Mg + Si = Mg2Si.
При взаємодії силіцидів з водою та кислотами утворюється суміш силанів (SinH2n+2), основним серед яких є моносилан - SiH4:
Mg2Si + 4HCl = 2MgCl2 + SiH4.
Силан при контакті з повітрям і водою самозаймається:
SiH4 + 2О2 = SiО2 + 2Н2О, SiH4 + 2Н2О = SiО2 + 4Н2.
Тому силани є пожежонебезпечними речовинами, які не можна гасити засобами, до складу яких входить вода.
З киснем Силіцій утворює оксид SiО2, який є найбільш стійкою сполукою Силіцію. Кристали диоксиду Силіцію зустрічаються у природі у вигляді мінералу кварцу. Звичайний пісок – це дрібний SiО2 з невеликою кількістю домішок. Пісок широко застосовується в будівництві, для виготовлення скла, цементу, кераміки. Пісок з давніх часів використовується як простіший засіб пожежогасіння. Диоксид Силіцію не реагує з кислотами, крім фторидної (плавикової):
SiО2 + 6НF = H2SiF6 + 2H2O.
За кімнатної температури SiО2 повільно реагує з лугами, у разі нагрівання швидкість реакції збільшується:
SiО2 +2NaOH = Na2SiO3 +H2O.
Ця реакція показує, що SiО2 – кислотний оксид. Диоксид кремнію з водою не реагує, тому кислоту, яка відповідає цьому оксиду одержують з солей силікатної кислоти – силікатів:
Na2SiO3 + H2SO4 = H2SiO3¯ + Na2SO4 .
Приклад 43.
Записати рівняння реакцій за допомогою яких можна здійснити такі перетворення:
HCl®H2®KH®KOH® KCl.
Для кожної речовини дати назву, вказати до якого класу неорганічних речовин відноситься кожна сполука.. Для окисно-відновних реакцій написати електроні рівняння, для іонообмінних – іонні рівняння.
Розв'язання.
1. 2HCl + Zn = ZnCl2 + H2,

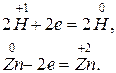
2. H2 +2 K = 2KH,
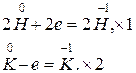
3. KH + H2O = KOH + H2.

4. KOH + HCl = KCl + H2O,
K+ +OH– + H++Cl– = K++Cl– + H2O, Н+ + OH– = H2O.
Назви речовин та класи сполук: HCl – хлоридна кислота, H2 – водень, неметал, KH – гідрид калію, KOH – гідроксид калію.
Запитання для самоконтролю
1. Як змінюються неметалічні властивості в групах і періодах періодичної системи елементів?
2. Які неметали найбільш поширені у земній корі?
3. Яке значення має озон для життя на землі?
4. Які елементи не можуть проявляти додатні ступені окиснення?
5. В контакті з яким металом горить вода?
6. Який склад має повітря? Яка складова частина повітря підтримує горіння?
7. Яка кислота легко реагує зі склом?
8. В чому різниця в дії концентрованої та розведеної сульфатної кислоти на метали?
9. Що таке гідриди металів? Чи можна для їх гасіння використовувати воду?
10. Що таке гіпс? Де він застосовується? Як впливає підвищена температура на влàстивості гіпсу?
11. Які сполуки утворює азот з воднем та киснем? Чи можуть вони бути причиною пожежі?
12. Що таке нітриди?
13. Що таке піротехнічні генератори аерозолів?
14. Які вам відомі будівельні матеріали на основі сполук кремнію?
15. Що таке карбіди металів? Як вони реагують з водою?
16. В чому різниця в дії на людину вуглекислого та чадного газу?
Читайте також:
- OПТИЧНІ ВЛАСТИВОСТІ КОЛОЇДНИХ СИСТЕМ
- А) Товар і його властивості.
- Аеродинамічні властивості колісної машини
- Алкани (насичені вуглеводні). Хімічні властивості алканів
- Алкани, їх хімічні властивості.
- Алкени. Хімічні властивості
- Алкіни. Хімічні властивості
- Аміни. Фізичні та хімічні властивості аліфатичних амінів.
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- АНТИДЕТОНАЦІЙНІ ВЛАСТИВОСТІ
- Арифметичні дії над дійсними невід’ємними числами. Їхні властивості
| <== попередня сторінка | | | наступна сторінка ==> |
| Хімічні властивості нітрогену та фосфору | | | РОЗДІЛ 6. ХІМІЯ ОРГАНІЧНИХ СПОЛУК |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |