
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Елементоорганічні сполуки та їх пожежонебезпечність
Метали з органічними сполуками утворюють металоорганічні сполуки з сильно полярними зв’язками. Вони нелеткі й нерозчинні в органічних розчинниках.
Більшість елементорганічних сполук можна одержати в результаті реакцій елементів з галогеноалканами:
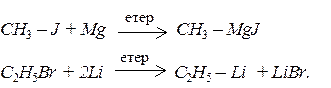
Таким чином реагує з галогенпохідними велика кількість елементів. Цей засіб найчастіше застосовується для отримання магнійорганічних сполук (реактивів Гриньяра) й літійалканів.
Металоорганічні сполуки відрізняються дуже великою реакційною здатністю, деякі з них на повітрі самозаймаються.
Для металоорганічних сполук характерні реакції зі сполуками, які мають активний гідроген:
СН3MgJ + HA ® CH4 + J – Mg – A.
Наприклад:
СН3MgJ + H2O ® CH4 + Mg(OH)J
СН3MgJ + H2N – R ® CH4 + R – NH – MgJ .
Диоксид вуглецю легко приєднує металоорганічні сполуки з утворенням карбонових кислот:

За невеликим винятком, металоорганічні сполуки токсичні для людей та тварин. Токсичність залежить від природи елемента й будови сполуки. Найбільш токсичні сполуки арсену, стибію, меркурію.
Найбільш активні, з хімічної точки зору, елементоорганічні сполуки натрію, літію, калію. Вони розкладаються без плавлення при нагріванні, на повітрі самозаймаються .
Розглянувши хімічні властивості елементоорганічних сполук, можна зробити висновок, що ці сполуки не можна гасити водою, а також диоксидом карбону.
Запитання для самоконтролю.
1. Які функціональні групи відповідають: а) нітросполукам, б) амінам?
2. Що таке реакція нітрування?
3. Який кінцевий продукт відновлення нітросполук?
4. Чому аміни проявляють основні властивості?
5. Що таке білки? Яке вони мають значення?
6. Які нітрогенвмісні сполуки вибухонебезпечні?
7. Які сполуки назвають елементоорганічними?
8. У чому складність гасіння елементоорганічних сполук?
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Азоновмістні органічні сполуки.
- Азосполуки
- Азот, фосфор, біогенні елементи та їх сполуки, органічні речовини
- Ароматичні сполуки і фітонциди
- Барбітурати і споріднені з ними сполуки.
- Високомолекулярні сполуки ВМС
- Вуглеводи – складні органічні сполуки, до складу яких входять атоми вуглецю (С), кисню (О) та водню (Н).
- Галогени та галогеновмісні сполуки.
- Галоїдні сполуки
- Гемоглобін, будова, властивості, види, сполуки.
- Гідрогеновмісні сполуки неметалів
| <== попередня сторінка | | | наступна сторінка ==> |
| Амінокислоти як мономери білків | | | Тема 19. Полімерні матеріали. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |