
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Ковалентний зв’язок
Якщо ядра атомів діють на зовнішні електрони з близькою за величиною силою, створюється рівноважна система, у якій має місце збалансоване притягання протилежно заряджених часток і відштовхування однаково заряджених. У цьому випадку реалізовується так званий ковалентний зв’язок.
 Уперше на прикладі водню В. Гайтлер і Ф. Лондон розглянули такий варіант взаємодії атомів. На рис. 12 показана запропонована ними схема сукупних взаємодій протонів і електронів у молекулі водню.
Уперше на прикладі водню В. Гайтлер і Ф. Лондон розглянули такий варіант взаємодії атомів. На рис. 12 показана запропонована ними схема сукупних взаємодій протонів і електронів у молекулі водню.
|
У подальшому уявлення В.Гайтлера і Ф.Лондона щодо механізму утворення ковалентного зв’язку в молекулі водню були застосовані й до більш складних молекул.
Виходячи з такої схеми ковалентний зв’язок спочатку зображали у вигляді двох крапок між символами атомів, які хімічно взаємодіють між собою:

|
Ці пари крапок відповідали сумісним парам електронів. Потім їх замінили рисками:
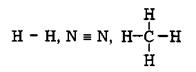
|
що дало змогу зображати просторову будову молекул.
Залежно від того, які орбіталі (s, p, d, f) і як взаємодіють між собою, можуть утворюватись різні типи ковалентного зв’язку: s, p чи d.
У випадку утворення s-зв’язку електронні хмари мають лише одну зону перекриття:

s s s(s,s)
p s s(p,s)

p p s(p,p)

d s s(d,s)
У процесі утворення p-зв’язку електронні хмари мають дві зони перекриття. Такий варіант взаємодії зі зрозумілих геометричних міркувань можливий для p, d та f електронів:

p p p(p,p)

p d p(p,d)
Більш складні за формою d і f електронні хмари можуть мати 4 зони перекриття. У цьому випадку утворюється d-зв’язок, зумовлений перекриттям усіх пелюстків орбіталей, розміщених у паралельних площинах.
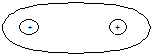
Якщо ковалентний зв’язок утворюють однакові атоми, то сумісна електронна пара симетрично й рівномірно розташовується між їх ядрами (рис. 12, а). Такий зв’язок є неполярний. Коли взаємодіють атоми різних хімічних елементів, то задіяні в утворенні зв’язку валентні електрони з різною силою притягуються ядрами, внаслідок чого відбувається зміщення електронної пари в бік більш активного атома (рис. 12, б). Такий зв’язок називається полярним.
| Н–Н | НH®Cl |
|  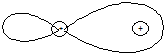
|

| 
|
| q1 = q2 = qe | |q1| < |q2| |
а б
Рис. 12. Розподіл заряду сумісної електронної пари в молекулах:
а – Н2; б – HСl
Кількісно ступінь полярності ковалентного зв’язку оцінюють, з одного боку, за величиною набутого атомами надлишку електронного заряду, а з іншого – його дефіциту. Для цього застосовують співвідношення
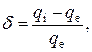
яке називають ефективним зарядом.
У випадку молекули HCl dН = +0,17, dCl = -0,17. Під час переходу від HCl до молекули H2S полярність одиничного ковалентного зв’язку H-S зменшується, а ефективний заряд атома Сульфуру порівняно з атомом Хлору збільшується: dН = +0,1, dS = -0,2.
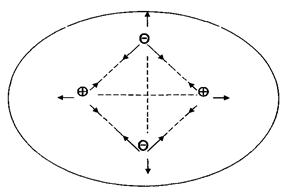
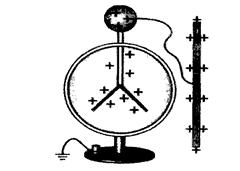
Полярність ковалентного зв’язку впливає, а інколи й дуже суттєво, на геометрію молекули, якщо в ній більше ніж два атоми. Ті атоми, які набувають однакового за знаком заряду, відштовхуються один від одного, як пелюстки в електрометрі (рис. 13). Чим більший заряд локалізується на атомах, тим більшими стають сили відштовхування і валентний кут a.
| dО= -
  О О
 Н Н
dН= + dН= + Н Н
dН= + dН= +
|
Рис. 13. Ефект електростатичної взаємодії:
а – в електрометрі; б – у молекулі води
Так, в ряді молекул H2Te, H2Se, H2S, H2O величина a збільшується від 90° до 104,5° пропорційно збільшенню ефективного заряду на атомах Гідрогену (табл. 6).
Таблиця 6. Значення валентних кутів
| Сполука | H2Te | H2Se | H2S | H2O |
| Кут, a° | 92,2 | 104,5 |
У наведеній групі молекул атоми центрального елемента (Te, Se, S, O) для взаємодії з атомами Гідрогену використовують два валентні р-електрони, а вони, як відомо, розташовані в просторі під кутом 90°. Таким чином, якби атоми Гідрогену не відштовхувались один від одного, то валентний кут у молекулах типу H2E становив би 90°. Відносно цього кута можна розрахувати збільшення a і зіставити Da з величиною dН.
Слід звернути увагу на те, що відштовхування атомів у складних молекулах не лише збільшує валентний кут, а і впливає на енергетику й геометрію зв’язувальних молекулярних орбіталей, тобто s-зв’язків. Інколи деформація буває настільки значною, що форма кінцевої молекулярної орбіталі повністю відрізняється від вихідної. У такому випадку говорять про гібридизацію s-зв’язків.
Наочно гібридизаційний ефект можна продемонструвати на класичному прикладі молекули метану. У ній атом Карбону для взаємодії з атомами Гідрогену в збудженому стані використовує один s і три р валентні електрони. У разі відсутності відштовхування полярних фрагментів у молекулі СН4 утворились би три s(s,p)-зв’язки і один s(s,s)-зв’язок, які мають принципово різну форму (див. схеми різних типів зв’язків). Замість цього утворюються чотири усереднені рівноцінні зв’язки нової форми.
За типом і кількістю валентних атомних електронів, задіяних в утворенні такого виду зв’язків, характеризують тип гібридизації. Так, у молекулі СН4 має місце sp3-гібридизація, у молекулі BF3 - sp2-гібридизація, у молекулі BeF2 – sp-гібридизація. Установити факт гібридизації можна за величиною валентного кута (табл. 7)
Таблиця 7. Типи молекулярних структур
| Тип гібридизації | sp3 | sp2 | sp |
| Валентний кут | 109°28¢ | 120° | 180° |
| Структура | тетраедрична | плоска трикутна | лінійна |
| Приклад | СH4, NH4+ | BF3, H3O+ | BeF2, CO2 |
У тих випадках, коли валентний кут наближається до вказаного в табл. 7, теж говорять про наявність гібридизації зв’язків. Так, у молекулі аміаку a=107°29¢ і це дає змогу характеризувати її як тетраедричну структуру, у якій четвертим фрагментом є пара s-електронів атома Нітрогену.
У молекулі РН3 a=94°, що вказує на деяку деформацію s-зв’язків, однак, не настільки сильну, щоб говорити про їх гібридизацію. У зв’язку з цим молекула фосфіну має пірамідальну структуру.
Читайте також:
- Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями.
- Антиінфляційна політика. Взаємозв’язок інфляції та безробіття.
- Біосфера, її складові, взаємозв’язок між ними.
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Взаємозв’язок адміністративно-процесуального права з іншими галузями права України
- Взаємозв’язок бюджету з іншими фінансовими планами
- Взаємозв’язок витрат і доходу. «Хрест» Кейнса
- Взаємозв’язок економічних і бухгалтерських витрат і прибутку
- Взаємозв’язок економічних і бухгалтерських витрат і прибутку
- Взаємозв’язок елементів управління
- Взаємозв’язок етики з іншими науками, що вивчають мораль
- Взаємозв’язок з освітніми системами інших країн, відповідність вищої освіти України світовому рівню.
| <== попередня сторінка | | | наступна сторінка ==> |
| Іонний зв’язок | | | ПІДСУМКИ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |