
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
Закони Рауля і принцип Вант-Гоффа не дійсні для розчинів електролітів (навіть нескінченно розведених). Ці розчини поводять себе так, нібито вони містять більше часток розчиненої речовини, ніж це випливає з їх концентрації. Реальні показники підвищення температури кипіння, зниження температури замерзання, осмотичний тиск цих розчинів завжди більші, ніж розраховані теоретично. Для врахування даних відхилень Вант-Гофф запропонував застосовувати ізотонічний коефіцієнт (і):
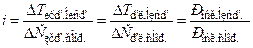 .
.
Отже, всі експериментальні значення в i разів більші за теоретичні:
Pосм. = і CRT; ∆tкип. = і Ке Сm; ∆tзам. = і Кк Сm.
Для неелектролітів і = 1.
Для електролітів: NaCl = Na+ + Cl- i =2;
CaCl2 = Ca2+ + 2Cl- i =3;
AlCl3 = Al3+ + 3Cl- i =4.
Експериментально, наприклад, для NaCl 1 < i < 2. Ці факти можна пояснити за допомогою теорії електролітичної дисоціації.
Читайте також:
- E) теорія раціонального вибору.
- ERG-теорія Клейтона Альдерфера
- I. Теорія граничної продуктивності і попит на ресурси
- V теорія граничної корисності визначає вартість товарів ступенем корисності останньої одиниці товару для споживача.
- Балансова теорія визначення статі. Диференціація статі і роль гормонів у цьому процесі.
- Біхевіоральна теорія
- В межах наукового підходу існує велика кількість концепцій, але найбільш переконлива – еволюційна теорія.
- Векторна теорія формування ЕКГ. ЕКГ, відведення. Походження зубців, сегментів, інтервалів ЕКГ.
- Взаємодія йонів солі, що утворюються в результаті електролітичної дисоціації з молекулами води, називається гідролізом солі.
- Взаємозв’язок психодинамічної теорії АСПН з іншими теоріями
- Відкрита архітектура (теорія Z)
- Глобалізаційні процеси в сучасній світовій культурі та теорія модернізації
| <== попередня сторінка | | | наступна сторінка ==> |
| Слід запам’ятати | | | Теорія електролітичної дисоціації Арреніуса |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |