
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ (до розділу 4.1-4.2)
1. Потрібно приготувати розчин масою 500 г із масовою часткою калій хлориду 14%. Визначити необхідні маси солі та води.
Розв’язання
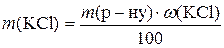 ;
;
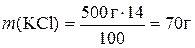 ;
;
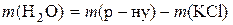 ;
;
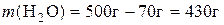 .
.
Таким чином, для приготування розчину треба взяти 70 г KCl і 430 г води.
2.Обчислити масу цинк хлориду, потрібну для приготування 250 мл його децинормального розчину.
Розв’язання
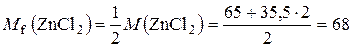 .
.
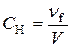 .
.
Підставимо в одержану формулу значення 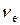 :
:
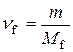 ,
,
тоді 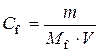 ,
,
звідси 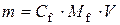 .
.
Таким чином, маса цинк хлориду 1,7 г.
У задачах часто розглядають змішування декількох розчинів однієї
і тієї ж речовини. Кожен розчин характеризується визначеними масами (m1 і m2) і масовими частками розчиненої речовини (w1 і w2) або процентними концентраціями. Після змішування маса утвореного розчину дорівнює сумі мас вихідних розчинів (m1+m2).
У процесі розв’язання задач даного типу, в алгебричних рівняннях застосовується закон збереження маси речовин. У рівнянні вказується, що маса розчиненої речовини під час змішування розчинів не змінилася. Її масу подають як добуток маси розчину і масової частки розчиненої речовини, вираженої десятковим дробом:
m1 +m2=(m1 + m2)w.
Одна з величин, наявних у рівнянні, звичайно є невідомою, її необхідно знайти. Серед компонентів, які змішуються, може бути чистий розчинник (його розглядають як розчин із концентрацією, що дорівнює нулю, тобто w = 0) і суха речовина без розчинника (його розглядають як розчин зі стопроцентною концентрацією, тобто w = 1).
3.Визначити, у якій кількості розчину з масовою часткою глюкози 5% необхідно розчинити її 120 г, щоб отримати розчин із масовою часткою глюкози 8%.
Розв’язання
Шукана величина х – маса розчину з масовою часткою глюкози 5%. В алгебричному рівнянні запишемо, що маса глюкози в утвореному розчині дорівнює її масі, яка міститься в х г розчину з ω = 5% плюс 120 г, що розчинили в останньому. Маса розчину, що утворився, дорівнює (х+120) г і в ньому міститься (х+120)∙0,08 г глюкози. У х г розчину з масовою часткою глюкози 5% знаходиться 0,05 г глюкози.
Схема зміни кількісного складу розчину під час розчинення глюкози така:
|
|
|
+ ®
Отже, (х+120)∙0,08 = 0,05х + 120, звідси х = 3 680.
Таким чином, глюкозу необхідно розчинити в 3 680 г розчину з масовою часткою глюкози 5%.
4.Визначити молярну та нормальну концентрації розчину сульфатної кислоти з масовою часткою H2SO4 14% (густина 1,57 г/мл).
Розв’язання
Молярну концентрацію визначають за формулою
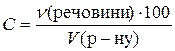 .
.
Виразимо C через дані умови задачі, застосовуючи такі залежності:
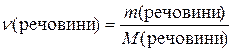 ;
;
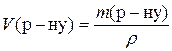 ;
;
Оскільки 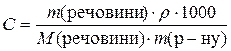 ,
,
де 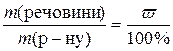 ,
,
то 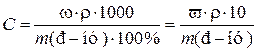 .
.
За умовою задачі 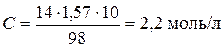 .
.
Аналогічно знаходимо нормальну концентрацію
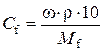 , де
, де 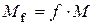 .
.
Тоді 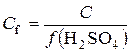 ; f(H2SO4)=1/2;
; f(H2SO4)=1/2;
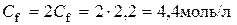 .
.
Таким чином, молярна концентрація H2SO4 - 2,2 моль/л, нормальна кон-центрація − 4,4 моль/л.
5. До розчину масою 80 г із масовою часткою натрій нітрату 12% додали воду масою 170 г. Розрахувати масову частку нітрату в одержаному розчині.
Розв’язання
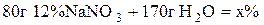 ;
;
1) 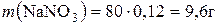 ;
;
2) 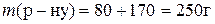 ;
;
3) 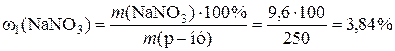 ;
;
Таким чином, масова частка натрій нітрату дорівнює 3,84%.
6. Знайти маси розчинів натрій хлориду з масовими частками 10% та 20%, необхідні для приготування 300 г розчину з масовою часткою 12%. У відповіді вказати масу розчину з масовою часткою 10%.
Задачі про змішування розчинів із різними масовими частками для приготування розчину із заданою масовою часткою можна розв’язувати, застосовуючи правило змішування (або правило хреста).
Розв’язання
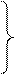
 1)
1) 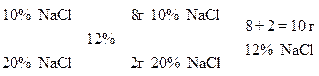
2) 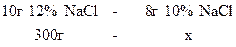
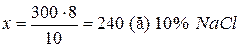 ;
;
3) аналогічно 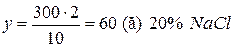 .
.
Відповідь: маса розчину з 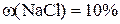 дорівнює 240 г, маса розчину
дорівнює 240 г, маса розчину 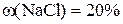 становить 60 г.
становить 60 г.
6. До розчину, який містить хлорид і карбонат натрію масою 22,3 г, додали надлишок розчину хлоридної кислоти. Після закінчення реакції розчин випарили. Маса твердого залишку 23,4 г. Обчислити масову частку (у відсотках) натрій хлориду у вихідній суміші.
Розв’язання
Складемо рівняння хімічної реакції:
Na2CO3 + 2HCl ® 2NaCl + CO2 + H2O
106 г/моль 2×58,5 г/моль
Позначимо кількість речовини натрій хлориду у вихідній речовині через х, а
натрій карбонату – через у моль. Відповідно до умови задачі масу вихідної суміші можна записати в такому вигляді: 58,5х + 106у = 22,3.
Обчислимо кількість речовини натрій хлориду (твердий залишок), що утворився після випарювання розчину:
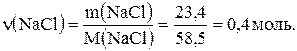
Відповідно до рівняння реакції 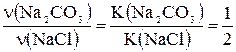 ,
,
тоді 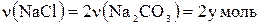 .
.
Згідно з умовою задачі кількість речовини твердого залишку є сумою кількості речовини натрій хлориду, що входить до складу вихідної суміші, і кількості речовини натрій хлориду, що утворився в результаті реакції:
х + 2у = 0,4.
Складемо систему рівнянь і розв’яжемо її:
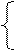 58,5х+106у=22,3 ,
58,5х+106у=22,3 ,
х+2у=0,4 ,
звідки х = 0,2; у = 0,1.
Розрахуємо масову частку натрій хлориду у вихідній суміші так:
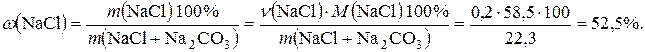 Відповідь: масова частка натрій хлориду у вихідній суміші 52,5%.
Відповідь: масова частка натрій хлориду у вихідній суміші 52,5%.
8. Визначити концентрацію іонів малорозчинного електроліту в його насиченому розчині. Добуток розчинності BaF2 при 18ºC дорівнює1,7∙10−6. Розрахувати концентрацію іонів Ba2+ та F− у насиченому розчині BaF2 за цієї температури.
Розв’язання
BaF2 розпадається за рівнянням
BaF2 ↔ Ba2+ + 2F−.
У процесі дисоціації BaF2 іонів F− одержується в 2 рази більше, ніж іонів Ba2+. Отже, [F−] = 2[Ba2+]. Добуток розчинності солі
ДРBaF2 =[Ba2+] [F−]2.
Якщо виразити концентрацію іонів F− через концентрацію іонів Ba2+, то
ДРBaF2 = [Ba2+] (2[Ba2+])2= 4 [Ba2+]3 = 1,7∙10−6.
Концентрація іонів Ba2+ дорівнює
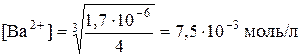 .
.
Концентрація іонів F− дорівнює
F− = 7,5∙10−3∙2 = 1,5∙10−3 (моль/л).
9. Визначити рН та рОН децимолярного розчину нітратної кислоти.
Розв’язання
Нітратна кислота – сильний електроліт. Тому [H+] = C(HNO3) = 0,1 моль/л;
рН = −lg 0,1 = 1; pOH = 14 − 1 = 13.
Читайте також:
- I. Застосування похідної та інтеграла до роз’язування задач елементарної математики.
- А) Задачі, що розкривають зміст дій
- АВТОМАТИЗАЦІЯ РОЗВ’ЯЗУВАННЯ КОМПЛЕКСУ ЗАДАЧ З ОБЛІКУ ОСНОВНИХ ЗАСОБІВ ТА НЕМАТЕРІАЛЬНИХ АКТИВІВ
- Активи, що реалізуються повільно (А3) – це статті 2-го розділу активу балансу, які включають запаси та інші оборотні активи (рядки 100 до 140 включно, а також рядок 250).
- Алгоритм розв’язання задачі
- Алгоритм розв’язання задачі
- Алгоритм розв’язання розподільної задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
| <== попередня сторінка | | | наступна сторінка ==> |
| ОКИСНО-ВІДНОВНІ РЕАКЦІЇ | | | Задачі для самостійного розв’язування |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |