
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Методика виконання роботи
Перед титруванням знаходять потенціал електрохімічного окиснювання K4Fe(CN)6. Для цього знімають вольтамперну криву фероціаніду. Промивають Pt мікроелектрод у HNO3 (1:1) і Н2О. У електролізер вводять 1 мл титранту, додають 30 мл фонового електроліту, замикають ланцюг, включають електромотор, що обертає робочий мікроелектрод, і поступово змінюючи зовнішню ЕРС в інтервалі 0–1,4 В через кожні 0,2 В, реєструють показання мікроамперметра. Будують на міліметровому папері функціональну залежність I–E і вибирають значення потенціалу, що відповідає граничному струму окиснювання K4Fe(CN)6.
Заданий об’єм аналізованого розчину CdSO4 (ZnSO4) поміщають у мірну колбу місткістю 50 мл, розчин розбавляють дистильованою водою до мітки, перемішують. Заповнюють мікробюретку розчином K4Fe(CN)6. У стаканчик для титрування (електролізер) відбирають піпеткою 5 мл розведеного аналізованого розчину, 30 мл фонового електроліту, занурюють електроди, включають електромотор, встановлюють потенціал, що відповідає граничному струму окиснювання титранту і титрують розчином K4Fe(CN)6, додаючи його порціями по 0,1 мл. Реєструють показання мікроамперметра після кожного додавання реактиву. Титрування проводять 2–3 рази. За результатами титрування, зведеним у таблицю (табл. 7.4) будують криву в координатах 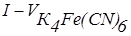 . По злому на цій кривій визначають об’єм розчину K4Fe(CN)6, що відповідає точці еквівалентності. Розраховують масу Cd2+ (Zn2+) у задачі за формулою
. По злому на цій кривій визначають об’єм розчину K4Fe(CN)6, що відповідає точці еквівалентності. Розраховують масу Cd2+ (Zn2+) у задачі за формулою
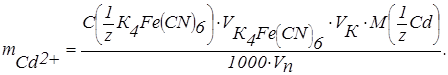
Таблиця 7.4
| Додано, K4Fe(CN)6, мл | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1,0 |
| Показання мікрогальванометра (ділення шкали) | … | … | … | … | … | … | … | … |
7.2. Визначення свинцю в технічному Pb(NO3)2
Читайте також:
- B. Тип, структура, зміст уроку і методика його проведення.
- I. Аналіз контрольної роботи.
- I. ОСНОВНІ ЕТАПИ ВИКОНАННЯ КУРСОВОЇ РОБОТИ
- II. Вимоги безпеки перед початком роботи
- II. Вимоги безпеки праці перед початком роботи
- II. СТРУКТУРА ТА ОБСЯГ КУРСОВОЇ РОБОТИ
- II.ТЕОРЕТИЧНІ ПИТАННЯ КУРСОВОЇ РОБОТИ
- III ОФОРМЛЕННЯ І ЗАХИСТ РОБОТИ
- III. Виконання бюджету
- III. Вимоги безпеки під час виконання роботи
- III. Вимоги безпеки під час виконання роботи
- III. Вимоги безпеки під час виконання роботи
| <== попередня сторінка | | | наступна сторінка ==> |
| ПРИКЛАДИ ВИЗНАЧЕННЯ РЕЧОВИН АМПЕРОМЕТРИЧНИМ ТИТРУВАННЯМ | | | Принцип методу |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |