
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Місце неметалічних елементів у періодичній системі. Загальна характеристика неметалів
Скористаємось фрагментом періодичної системи хімічних елементів Д. І. Менделєєва (рис. 9).
Неметалічні елементи – це ряд р–елементів VII, VI, V, IV груп, Бор – елемент ІІІ групи та Гідроген s–елемент І групи періодичної системи елементів. Атоми неметалічних елементів мають на зовнвшньому енергетичному рівні чотири електрони і більше (у Гідрогену – один, у Бору – три). Неметалічні елементи утворюють прості речовини – неметали.
Особливості будови атомів неметалічних хімічних елементів розглянемо на прикладі елементів одного періоду й однієї підгрупи.
Приклад 1. Неметалічні елементи одного періоду.
Неметалічні елементи Бор, Карбон, Нітроген, Оксиген, Флуор і Неон належать до другого періоду періодичної системи хімічних елементів і мають такі електронні формули атомів:
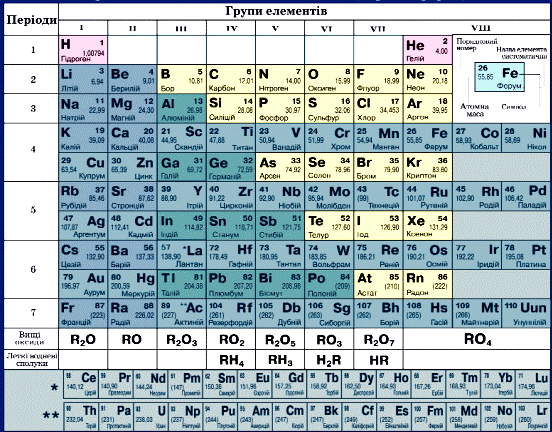
Рис 9. Розміщення неметалічних елементів у періодичній системі хімічних елементів
5В 1s2 2s2 2p1
6C 1s2 2s2 2p2
7N 1s2 2s2 2p3
8О 1s2 2s2 2p4
9F 1s2 2s2 2p5
10Ne 1s2 2s2 2p6
За цими формулами чітко простежується однакова будова першого енергетичного рівня неметалічних елементів другого періоду й поступове збільшення числа електронів на другому (зовнішньому) енергетичному рівні, доки останній елемент Неон не досягне завершеності зовнішнього енергетичного рівня. Починаючи з Нітрогену, в атомах цих хімічних елементів спостерігається поступове зменшення кількості неспарених електронів на зовнішньому енергетичному рівні. Так, атом Нітрогену здатний утворити три спільні електронні пари з іншими атомами, Оксигену – дві, Флуору – одну. В атомі Неону відсутні неспарені електрони, і він не утворює хімічних зв’язків з іншими атомами.
Розглянуті приклади доводять, що атоми неметалічних елементів другого періоду мають по 2 енергетичних рівні, але відрізняються кількістю електронів на зовнішньому енергетичному рівні.
Особливістю атомів неметалічних елементів є те, що кількість електронів на зовнішньому енергетичному рівні збігається з номером групи. Тому без запису електронної формули атома, наприклад, неметалічного елемента VII групи Астату можна з упевненістю сказати, що з 85 електронів його електронної оболонки 7 містяться на зовнішньому енергетичному рівні.
Приклад 2. Неметалічні елементи однієї підгрупи.
Карбон і Силіцій розташовані в IV групі в головній підгрупі періодичної системи хімічних елементів, тобто є елементами однієї групи й підгрупи. Напишемо електронну формулу атома Силіцію: 14Si 1s22s22p6 3s23p2.
Скористаємося електронною й графічною електронною формулами атома Карбону й порівняємо електронні формули атомів цих хімічних елементів. Результати порівняння вказують на те, що електронні оболонки їх атомів відрізняються кількістю енергетичних рівнів, проте на зовнішньому енергетичному рівні в них однакова кількість електронів і вона чисельно дорівнює номеру групи.
Електронні формули атомів Карбону і Силіцію свідчать, що неметалічні елементи IV групи головної підгрупи мають однакову будову зовнішнього енергетичного рівня і кількість електронів на ньому дорівнює половині електронів зовнішнього завершеного восьмиелектронного енергетичного рівня.
Знання будови атомів і місця в періодичній системі неметалічних елементів дають змогу давати їх загальну характеристику із зазначенням групи, підгрупи, періоду, ряду, будови атома, формул летких водневих сполук, оксидів із найвищим ступенем окиснення.
Приклад 3. Характеристика неметалічного елемента за будовою атома й розміщенням у періодичній системі.
Хімічний елемент з протонним числом 52 – Телур Те – розташований у періодичній системі хімічних елементів у п’ятому періоді, сьомому ряді, VI групі, головній підгрупі.
Відносна атомна маса 128. Ядро атома має заряд +52 і складається з 52 протонів і 76 нейтронів (128 – 52 = 76). Електронна оболонка атома налічує 52 електрони, які розташовані на п’ятьох енергетичних рівнях. На зовнішньому енергетичному рівні є 6 електронів, тому максимальна валентність Телуру 6, максимальний ступінь окиснення +6.
Формула вищого оксиду – ТеО3. Оскільки Телур – аналог (так називають елементи однієї підгрупи) Оксигену і Сульфуру, то це дає змогу записати електронну конфігурацію зовнішнього енергетичного рівня як …5s2 5p4 .
Якщо зобразити графічну електронну формулу зовнішнього енергетичного рівня то можна побачити, що для його завершення не вистачає 2 електронів, тому з Гідрогеном Телур утворює сполуку Н2Те.
Читайте також:
- I. Загальна характеристика політичної та правової думки античної Греції.
- II. ВИРОБНИЧА ХАРАКТЕРИСТИКА ПРОФЕСІЇ
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- II. Морфофункціональна характеристика відділів головного мозку
- Ni - загальна кількість періодів, протягом яких діє процентна ставка ri.
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Автобіографія. Резюме. Характеристика. Рекомендаційний лист
- Автокореляційна характеристика системи
- Автоматизоване робоче місце метролога
- Автономна Республіка Крим, регіональні та місцеві органи державної влади.
- Амплітудно-частотна характеристика, смуга пропускання і загасання
- Аналіз службового призначення деталей та конструктивних елементів обладнання харчових виробництві, визначення технічних вимог і норм точності при їх виготовленні
| <== попередня сторінка | | | наступна сторінка ==> |
| | | Фізичні та хімічні властивості неметалів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |