
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Розділ ІІ. Ферменти
Розділ І. Білки
ВИЗНАЧЕННЯ БІОМОЛЕКУЛ В КЛІТИНАХ РІЗНОГО ПОХОДЖЕННЯ. Білки, ферменти
Лабораторна робота 2
Мета роботи: ознайомлення з основними методами якісного визначення біомолекул та дослідження наявності біомолекул в клітинах різного походження.
Короткі теоретичні відомості
Білки - високомолекулярні поліпептиди, які складають 10–18% загальної маси клітини. Тільки в організмі людини зустрічається близько 5 мільйонів типів білкових молекул, які відрізняються за своєю масою, структурою та функціями не тільки один від одного, але і від білків інших організмів.
Всі білки побудовані з 20 різних амінокислот, котрі поєднуються між собою за допомогою пептичного зв’язку утворюючи поліпептидні ланцюги. Послідовність амінокислот в поліпептидному ланцюзі називають первинною структурою білку. Після свого утворення поліпептидний ланцюг згортається у спіраль і утворює вторинну структуру білку. Третинна білкова структура формується завдяки взаємодії радикалів амінокислот. Більшість білків проявляють свою біологічну активність у вигляді третинної структури. Для виконання деяких функцій організму необхідним є участь білків з ще більш високим рівнем організації. Агреговані певним чином пептидні ланцюги, які виконують свої функції тільки в такому стані називають білками з четвертинною структурою (наприклад, гемоглобін).
Функції білків в клітинах найрізноманітніша: будівельна, каталітична, транспортна, захисна і т.д.
Матеріали й реактиви
Рослинна сировина яка містить білок (насіння гороху, сої, квасолі), м’ясо, альбумін курячого яйця, 5% розчин гідроксиду натрію (калію), 1% розчин сульфату міді.
Обладнання
Пробірки, піпетки на 1, 2 і 10 мл, ступка, фільтри паперові (жовта стрічка), фільтрувальна тканина, лійка.
Біуретова реакція
Якісне визначення білка біуретовою реакцією полягає у утворенні комплексу фіолетового кольору при взаємодії пептидних зв’язків білку з іонами міді (ІІ) у лужному середовищі.
Хід роботи
Подрібнити в ступці 2-3 г сировини. Залити 10 мл дистильованої води. Відфільтрувати. Налити в одну пробірку 2 мл отриманого розчину білку, в другу 2 мл дистильованої води. В обидві пробірки додати по 2 мл 5% гідроксиду натрію (калію) і змішати, потім додати 1 мл 1% розчину сульфату міді і перемішати. Спостерігається зміна забарвлення.
Короткі теоретичні відомості
Ферменти (ензими) - це білки-каталізатори, які здатні значною мірою (в 106 - 1012 разів) прискорювати перебіг різних хімічних реакцій. Ферменти відрізняються від хімічних каталізаторів будовою, специфічністю дії, температурним та рН оптимумом, участю води, більшою швидкістю реакцій, інгібіторами тощо. Ці відмінності зумовлені білковою природою ферментів.
Матеріали й реактиви
Розчин Люголя, дистильована вода, препарат амілази слини, 5% розчин сечовини, розчин фенолфталеїну, 0,01% розчин уреази або препарат уреази (готується заздалегідь з соєвого борошна та з додаванням НСІ 0,1 М, толуолу), препарат сахарази (готується з дріжджів), 2% розчин сахарози, реактив Фелінга
Обладнання
Штатив з пробірками, циліндр на 50-100 мл, склянки, лійки, фільтрувальний матеріал (вата), піпетки, крапельниці, фарфорова ступка з пестиком, лійки, термостат, водяна баня, газовий пальник.
1. Визначення амілази
Амілази (від лат. amilym - крохмаль) - ферменти, які каталізують гідроліз 1,4‑глікозидних зв’язків у молекулах полісахаридів (крохмалю, глікогену) до глюкози, дисахаридів та олігосахаридів. Проміжні продукти гідролізу - декстрини. В залежності від ступеня деструкції, крохмаль утворює з йодом сполуки різного кольору: негідролізований крохмаль – синього, амілодекстрин - фіолетового, ерітродекстрин - червоно-бурого, ахродекстрин - жовтого.
Хід роботи
Ротову порожнину ополіскують 2-3 рази водою для видалення залишків їжі, відміряють циліндром 50 мл дистильованої води та ополіскують рот протягом 3-5 хвилин кілька разів. Зібрану рідину фільтрують через вату і використовують фільтрат як джерело ферменту.
У дві пробірки вносять по 0,5 мл отриманого розчину амілази. Після цього одну з них (контроль) обережно прогрівають на пальнику до закипання, а потім охолоджують. В обидві пробірки додають по 5 мл розчину крохмалю, добре перемішують і ставлять в термостат при 37°С. Через 15 хвилин у ці пробірки доливають по 5 крапель розчину Люголя. У пробірці з амілазою слини розчин через кілька хвилин буде безбарвним, у пробірці без амілази колір розчину не зміниться, залишиться синьо-фіолетовим.
2. Визначення уреази
Уреаза прискорює розщеплення сечовини з утворенням CO2 і NH3:
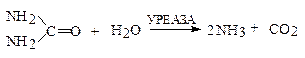
При цьому дія уреази характеризується абсолютною специфічністю, тобто цей фермент не діє на інші субстрати, навіть на похідні сечовини, наприклад на метилсечовину.
Про дію уреази судять по зміщенню рН розчину в лужну зону.
Хід роботи
Готують розчин уреази. Для цього до 8 г соєвого борошна додають 46 мл дистильованої води, 2 мл розчину НСІ (0,1 М), перемішують, вносять кілька крапель толуолу і залишають на ніч. Фільтрують.
У дві пробірки наливають по 1 мл розчину сечовини і по 5 крапель фенолфталеїну, в одну з них додають 5 мл отриманого розчину уреази, у другу – 5 мл дистильованої води, добре перемішують. Залишають суміші при кімнатній температурі на 2 години. У пробірці з уреазою розчин забарвлюється у рожевий колір. У пробірці без уреази колір розчину не змінюється.
3. Визначення сахарази
Сахараза каталізує гідроліз сахарози до глюкози та фруктози.
Утворені моносахариди визначають реакцією Фелінга.
Хід роботи
В ступці подрібнюють 1 г дріжджів з додаванням 5-8 мл дистильованої води. Потім фільтрують через вату в пробірку. Отриманий розчин містить сахаразу.
У дві пробірки наливають по 1 мл розчину ферменту. Вміст однієї з них (контроль) кип’ятять протягом 3 хвилин для руйнування сахарази. Після охолодження додають у пробірки по 3 мл розчину сахарози, добре перемішують і ставлять у термостат при Т=38°С. Через 15 хвилин в ці пробірки вливають по 2 мл реактиву Фелінга, перемішують і нагрівають до кипіння. У контрольній пробірці осаду немає, а в пробірці з активним ферментом (дослід) утворюється червоний осад геміоксиду міді.
Результати дослідів та висновки подаються у вигляді таблиці:
| № п/п | Біомолекули, що визначаються | Джерело біомолекул | Спостереження | Висновки |
Читайте також:
- Аварійно-рятувальні підрозділи Оперативно-рятувальної служби цивільного захисту, їх призначення і склад.
- Актив і пасив балансу складаються також з певних розділів.
- Активи, що реалізуються повільно (А3) – це статті 2-го розділу активу балансу, які включають запаси та інші оборотні активи (рядки 100 до 140 включно, а також рядок 250).
- Аналіз бойових дій пожежних підрозділів
- Б – розділення гелю на дві фази
- Біологічні каталізатори – ферменти
- Взаємодія органів слідства з підрозділами, уповноваженими здійснювати оперативно-розшукову діяльність, при розслідуванні злочинів
- Взаємодія підрозділів при проведенні виїзних планових та позапланових перевірок
- Взаємодія СВА з іншими структурними підрозділами підприємства.
- Взаємодія слідчого з оперативними підрозділами.
- Визначення та визнання запасів в підрозділах підприємств готельно-ресторанного господарства , їх оцінка та класифікація
- ВИКОРИСТАННЯ ОПЕРАТИВНИМИ ПІДРОЗДІЛАМИ ЗНАНЬ ПРО КОНФЛІКТИ В ЗЛОЧИННОМУ СЕРЕДОВИЩІ
| <== попередня сторінка | | | наступна сторінка ==> |
| Розділ ІІІ. Вітаміни | | | МІКРОСКОПІЧНИЙ МЕТОД ДОСЛІДЖЕННЯ ЕУКАРІОТИЧНИХ ТА ПРОКАРІОТИЧНИХ КЛІТИН |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |