
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Правила наближених обчислень.
ЗМІСТ
ПЕРЕДМОВА.. 3
РОЗДІЛ 1. ЗАКОНОДАВЧІ ТА НОРМАТИВНО-СТИЛЬОВІ
ОСНОВИ ПРОФЕСІЙНОГО СПІЛКУВАННЯ.. 4
Лекція 1. Державна мова – мова професійного спілкування. 4
Лекція 2. Основи культури української мови. 29
Лекція 3. Стилі сучасної української літературної мови
у професійному спілкуванні 46
РОЗДІЛ 2. ПРОФЕСІЙНА КОМУНІКАЦІЯ.. 63
Лекція 4. Спілкування як інструмент професійної діяльності 63
Лекція 5. Риторика і мистецтво презентації 87
Лекція 6. Культура усного фахового спілкування. 120
Лекція 7. Форми колективного обговорення професійних проблем. 143
Лекція 8. Ділові папери як засіб писемної професійної комунікації 157
Лекція 9. Документація з кадрово-контрактних питань. 166
Лекція 10. Довідково-інформаційні документи. 175
Лекція 11. Етикет службового листування. 183
РОЗДІЛ 3. НАУКОВА КОМУНІКАЦІЯ
ЯК СКЛАДОВА ФАХОВОЇ ДІЯЛЬНОСТІ 191
Лекція 12. Українська термінологія у професійному спілкуванні 191
Лекція 13. Науковий стиль і його засоби у професійному спілкуванні 219
Лекція 14. Проблеми перекладу і редагування наукових текстів. 255
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ.. 271
ДОДАТКИ.. 274
ЗРАЗКИ РІЗНОСТИЛЬОВИХ ТЕКСТІВ.. 274
Зразок художнього стилю.. 274
Зразок розмовного стилю.. 274
Зразок наукового стилю.. 275
Зразок офіційно-ділового стилю.. 275
Зразок оформлення реквізитів документа. 276
ЗРАЗКИ ОФОРМЛЕННЯ ДОКУМЕНТІВ.. 277
Зразок автобіографії 277
Зразок резюме. 277
Зразок характеристики. 278
Зразки заяв. 278
Зразок прес-релізу. 280
Зразок повідомлення про захід. 281
Зразок звіту. 281
Зразок рапорту. 282
Зразки доповідних записок. 282
Зразки пояснювальних записок. 283
Зразок довідки. 284
Зразок протоколу. 284
Зразок витягу із протоколу. 285
ЗРАЗКИ ОФОРМЛЕННЯ СЛУЖБОВИХ ЛИСТІВ.. 285
Зразки рекомендаційних листів. 285
Зразки листів-прохань. 286
Зразок листа-відповіді 287
Зразок супровідного листа. 287
Зразок листа-запрошення. 287
Зразок гарантійного листа. 288
Зразок листа-нагадування. 288
Зразок листа-підтвердження. 288
Зразок рекламаційного листа. 289
Зразок листа-привітання. 289
ЗРАЗКИ СКЛАДАННЯ ПЛАНУ.. 289
Зразок простого плану. 289
Зразок складного плану. 290
Зразок цитатного плану. 290
Зразок тезового плану. 290
Зразок оформлення титульної сторінки курсової роботи. 291
Зразок оформлення змісту курсової (дипломної) роботи. 293
Зразок анотації 294
Зразок рецензії 294
ТАБЛИЦІ. 297
Таблиця 1. Стандартні етикетні ситуації
та мовні формули їх вираження. 297
Таблиця 2. Класифікація форм мовного спілкування. 300
Таблиця 3. Види, типи і форми професійного спілкування. 301
Таблиця 4. Класифікація невербальних засобів спілкування. 302
Таблиця 5. Складові успішної презентації 303
Таблиця 6. Особливості індивідуальних
та групових форм прямого спілкування. 304
Таблиця 7. Класифікація документів. 304
Таблиця 8. Реквізити документів та правила їх оформлення. 306
Таблиця 9. Види прес-релізів. 319
Таблиця 10. Фрагмент стандарту на терміни. 319
Таблиця 11. Фрагмент класифікатора промислової продукції 319
Таблиця 12. Фрагмент рубрикатора з приладобудування. 320
Таблиця 13. Фрагмент частотного словника. 320
Таблиця 14. Мовні засоби організації інформації наукового тексту. 320
Таблиця 15. Лексико-граматичні засоби
для складання анотації наукової статті 323
Таблиця 16. Приклади оформлення бібліографічного опису. 323
Таблиця 18. Етикетні вислови науковців. 333
СХЕМИ... 334
Схема 1. Структура спілкування. 334
Схема 2. Складові стратегії спілкування. 334
При розв’язуванні задач ми маємо справу з наближеними числовими обчисленнями, які можна проводити за допомогою різних обчислювальних приладів, які при обчисленні дають велику кількість значущих цифр. При цьому треба розуміти, скількі цифр після коми треба залишити, а інші відкинути. Нижче наведені правила наближених обчислень:
а) при додаванні і відніманні результат округлюється так, щоб він не мав значущих ціфр в розрядах, які відсутні хоч би в одній із даних. Наприклад:
3, 351 + 2,45 + 1,2534 » 7,05
б) при множенні множники округлюють так, щоб кожен мав стільки значущих цифр, скільки їх має множник із найменшим їх числом. Наприклад:
2,51 х 1,2 х 5,245 » 2,5 х 1,5 х 5,2
У кінцевому результаті залишають таке ж число значущих цифр, які в множниках після округлення.
в) при діленні дотримуються такого ж правила, як і при множенні. Наприклад:
6,24 : 2,124 » 6,24 : 2,12
г) при піднесенні до квадрату або куба в результаті беруть стільки значущих цифр, скільки їх має основа ступені. Наприклад:
1,252 » 1,56
д) при винесенні квадратного кореня або кубічного в результаті беруть стільки значущих цифр, скільки їх має підкорений вираз. Наприклад:
Ö6,82 » 2,61
Такі ж правила треба застосовувати при обчисленні складних виразів.
Питання для самоконтролю.
1. Назвіть основні та додаткові одиниці системи СІ.
2. Які правила виведення похідних одиниць вимірювання деяких фізичних величин?
3. Виконайте вправи, наведені у додатку 1.
4. Які вимоги до побудови графиків?
5. Виконайте вправи, наведені в додатку 2.
Лекція №3
Тема: Основи молекулярно-кінетичної теорії (МКТ).
Мета: Ознайомити студентів з основними положеннями атомно-молекулярної теорії про будову речовини, явищем дифузії і з броунівським рухом; з основними властивостями речовини в різних агрегатних станах.
Оснащення: Таблиці, картки, опорні конспекти.
План лекції.
1. Основні положення МКТ.
2. Дослідне обгрунтування МКТ.
3. Молекулярні явища в техніці і природі.
4. Взаємодія атомів і молекул у різних агрегатних станах.
5. Маса і розміри молекул.
6. Швидкість молекул газу.
Література.
1. Гончаренко С.У. Фізика: Пробн. навч. посібник для ліцеїв та класів природничо-наукового профілю. 10 кл. – К.:Освіта, 1995.-430с; с…3-29
2. Л.С.Жданов, Г.Л.Жданов. Фізика для середніх спеціальних навчальних закладів, К., Вища школа, 1985, с.21… 37
3. Физика: Школьний курс. – М.:АСТ – Пресс, 2000, с.258… 260
Зміст лекції.
1. Основні положення МКТ.Думка про дискретну будову речовини зародилася в глибоку давнину, близько двох з половиною тисяч років тому. Найбільш послідовно атомне вчення розвинув давньогрецький філософ і природодослідник Демокріт (V ст. до н.е.). Однак, атомістичні уявлення були забуті і відроджені лише в другій половині XVIIст. Бойлем, а потім в XVIII – XIX ст розроблені Ломоносовим, Дальтоном, Больцманом, Максвеллом як научна теорія, що одержала назву класичної молекулярно-кінетичної теорії. Вона базується на таких положеннях:
а) усі види речовини складаються з молекул, між якими є міжмолекулярні проміжки;
б) молекули в будь-якій речовині безперервно і хаотично (безладно) рухаються;
в) на невеликих відстанях між молекулами (атомами) діють як сили притягання, так і сили відштовхування, природа цих сил електромагнітна.
Будь-яка речовина складається з молекул. (від латинського “молес” – маса, “кула” – зменшувальний суфікс). Молекулою називають найменшу частинку речовини, яка здатна самостійно існувати і зберігати хімічні властивості цієї речовини.
Молекули складаються з атомів. (від грецьк. слова “атомос” – неподільний) . Якщо при яких-небудь змінах у природі молекули залишаються незмінними, то речовина зберігає свої хімічні властивості, якщо ж молекули змінюють свою будову, або розпадаються на окремі атоми, то виникають нові види речовини з іншими хімічними і фізичними властивостями.
Речовини, які не можна розкласти на простіші скалдові, називаються хімічними елементами, наприклад: кисень, азот, свинець тощо. Кожному хімічному елементу відповідають атоми, які мають певний номер в таблиці Менделєєва. Сполучення атомів у групи утворює молекулу речовини. Сукупність однакових молекул становить певний вид речовини. Хімічні і фізичні властивості цієї речовини визначаються числом і видом атомів у її молекулах. Властивості речовини залежать також від внутрішнього розміщення атомів відносно один одного. Наприклад, графіт і алмаз складються з атомів вуглецю і з точки зору їх внутрішньої будови відрізняються лише відносним розміщенням цих атомів. Тим часом, фізичні властивості цих речовин різко відрізняються: алмаз має велику твердість, прозорий для променів світла і добрий ізолятор, а графіт – дуже м’який і непрозорий матеріал, провідник. Нарешті, властивості речовин визначаються ще й зовнішніми умовами. Усе це зумовлено тим, що молекули і атоми завжди взаємодіють одні з одними і мають хімічну енегрію. Саме рухом і взаємодією атомів і молекул пояснюється вся та невичерпна різноманітність величезної більшості явищ природи, які ми спостерігаємо.
2. Дослідне обгрунтування МКТ.
Як показує дослід, усі гази легко стисливі. Це доводить, що між молекулами газу є значні вільні проміжки. Рідини і тверді тіла також стисливі, але менше, ніж гази. Це означає, що в рідинах і твердих тілах також є міжмолекулярні проміжки, але значно менші, ніж у газах.
Внаслідок взаємного проникнення молекул однієї речовини між молекулами іншої відбувається змішування різних газів або рідин, розчинення твердих тіл у рідинах, випаровування рідин і твердих тіл.
Намагання молекул газу зайняти весь належний йому об’єм показує, що молекули газу перебувають у бесперервному хаотичному русі. Хаотичний рух називають тепловим, бо від тісно пов’язаний з поняттям температури: чим вище температура тіла, тим інтенсивніший тепловий рух його молекул, тим більше кінетичної енергії припадає в середньому на одну його молекулу. Оскільки кінетична енергія пропорційна квадрату швидкості руху, то при нагріванні тіла середня швидкість руху його молекул збільшується, а при охолодженні – зменшується.
Слід зазначити, що явища, які вивчаються в молекулярній фізиці, визначаються рухом і взаємодією безлічі молекул; тому для опису таких явищ користуються лише середніми значеннями величин, які характеризують молекулярний світ.
Одим з поширених явищ природи, яке пояснюється хаотичним рухом молекул, є явище дифузії (від латинського “дифузіо” – розтікання). Прикладом дифузії може бути поширення запаху квітів або їжі, яка готується. Внаслідок випаровування концентрація молекул пахучих речовин у безпосередній близькості від букета квітів більша, а хаотичний тепловий рух молекул змішує молекули повітря і пахучих речовин, що й спричиняє поширення запаху по всій кімнаті. Таке перемішування веде до вирівнювання концентрації молекул пахучих речовин у всьому об’ємі комнати. Процес вирівнювання концентрації молекул якоїсь речовини в просторі, зумовлений хаотичним рухом молекул, називається дифузією. Оскільки середня швидкість хаотичного руху молекул зростає при підвищенні температури, то дифузія має прискорюватися з підвищенням температури, що підтверджують усі досліди.
У рідинах дифузія відбувається значно повільніше, ніж у газах. У твердих тілах дифузія відбувається дуже повільно, і помітити її можна при підвищенні температури. Якщо щільно притиснути одну до одної дві різнорідні металеві пластинки і тримати їх при температурі в кілька сот градусів, то взаємну дифузію металів буде помітно уже через кілька годин. Це можна виявити, якщо роз’єднати пластинки, а потім дослідити вид поверхні. Повільніша дифузія в рідинах, ніж у газах, в твердих тілах ніж у рідинах пояснюється тим, що в рідинах молекули розміщені ближче одна до одної, ніж у газах, а сили взаємного притягання молекул сповільняють процес дифузії. Оскільки в твердих тілах молекулярні сили більші, ніж у рідинах, процес дифузії в твердих тілах відбувається ще повільніше.
Важливий випадок дифузії – взаємне проникнення речовин крізь пористі перегородки, яке дістало назву осмос.
Одним з найбільш переконливих доказів існування молекул і їх хаотичного теплового руху є броунівський рух, названий так на честь англійського ботаніка Броуна. Розглядаючи в мікроскоп краплину води, Броун звернув увагу на невпорядкований рух плаваючих у ній спор рослин: ці частинки здійснювали своєрідний “вічний танок”. У броунівському русі вражає одна незвична для нас особливість – рух частинок не припиняється за будь-яких обставин, хоча під час дослідження його причин вживалися запобіжні заходи, які виключали можливість зовнішніх впливів на броунівські частинки. Характер їх руху не змінювався. Отже, причину руху броунівських частинок слід шукати в самій рідині.
Правильне якісне пояснення броунівського руху було дано у другій половині XIX ст. Молекули води весь час перебувають у хаотичному русі, і завислі у воді частинки речовини зазнають поштовхи молекул з усіх боків. Досліди свідчать, що інтенсивність броунівського руху тим більша, чим вища температура рідини, що ще раз підтверджує безпосередній зв’язок теплового руху молекул з рухом броунівських частинок.
3.Молекулярні явища в техніці і природі.
Явище дифузії має надзвичайно різноманітні галузі практичного застосування. Насамперед це зварювання і паяння металів: ці процеси грунтуються на дифузії зварюваних металів або основного металу і припою.
В останні роки опрацьовано і впроваджено у виробницьтво метод дифузійного зварювання у вакуумі. Для цього зварювані деталі поміщають у вакуумну камеру і нагрівають до температури, при якій процес дифузії в металах проходить досить інтенсивно. Потім деталі притискають одну до одної і витримують певний час. Перевага цього методу полягає в тому, що він дає змогу зварювати матеріали, які іншими методами з’єднати неможливо (сталь з чавуном, алюмінієм, вольфрамом, срібло з нержавіючою сталлю.)
Дифузія широко застосовується в металургії, зокрема під час поверхневої термохімічної обробки металів і сплавів з метою зміни механічних властивостей їх поверхневого шару. Так, для підвищення строку служби машин, які працюють в умовах великих навантажень, сталеві деталі піддають азотуванню – насиченню поверхні сталі азотом. Готові деталі нагрівають в аміаку до температури 500 – 7000 С. Утворений при цьому атомарний азот дифундує в сталь. Азотування надає поверхні вироби винятково високої твердості, стійкості проти зношення, антикорозійності для таких середовищ, як атмосфера, вода, водяна пара.
Поліпшення властивостей матеріалів досягається при таких аналогічних азотуванню процесах, як цементація (поверхневе насичення сталевих виробів вуглецем) і ціанування (одночасне насичення поверхні деталі вуглецем і азотом).
Великого значення в сучасній техніці набула дифузійна металізація виробів, тобто поверхневе насичення сталевих виробів алюмінієм, хромом, кремнієм, берилієм та іншими елементами.
На дифузії грунтується вилучення на цукроварних заводах цукру з нарізаної бурякової стружки. Стружка промивається водою або цукровим розчином малої концентрації, і при цьому молекули цукру дифундують із стружки в розчин.
Явище дифузії рідин через пористі перегородки відіграє велику роль в житті тварин і рослин, забезпечуючи всмоктування води коренем рослин, засвоєння їжі і видалення відходів із клітин рослин і тварин. Так, корені рослин захоплюють необхідні для них речовини з грунтових вод завдяки дифузії цих речовин в середину коренів, де речовини швидко засвоюються, тобто хімічно перетворюються. Внаслідок цього концентрація біля поверхні коренів виявляється весь час зниженою, що й сприяє продовженню дифузії потрібних речовин з оточуючого грунту в корені.
Аналогіно відбувається дифузія в тканинах тварин і людини. В легенях, наприклад, кисень з повітря надходить у кров завдяки дифузії через стінки альвеол, а потім розчинившись у неї, розноситься по всьому організму. Їжа перетворюється в шлунку і кишечнику в розчинний стан, і потрібні організмові речовини дифундують в середину кліток. У той же час внаслідок дифузії продукти життєдіяльності клітки виводяться з неї в оточуюче середовище.
Броунівський рух – одне з найпоширеніших явищ. Воно має не лише принципове значення для підтвердження молекулярно-кінетичної теорії, а і практичне. Зокрема, броунівський рух електронів створює електро- і радіоперешкоди в різних технічних пристроях. Його доводиться враховувати під час створення дуже чутливих вимірних приладів, стрілки чи дзеркала яких, маючи малі розміри, зазнають нескомпенсованих ударів з боку молекул повітря. Це вносить похибки у вимірювання і обмежує точність приладів.
Взаємодія атомів і молекул у різних агрегатних станах.
Існування сил притягання між молекулами переконливо доводить той факт, що тверді тіла і рідини не розпадаються на окремі молекули, хоча частинки цих речовин розділені проміжками і перебувають у безперервному русі. Більше того, для зміни форми твердого тіла до нього слід прикласти деяку силу. Очевидно, молекули зв’язані між собою силами притягання, і саме ці сили ми долаємо, обробляючи матеріали на металорізальних верстатах, пресах, прокатних станах, розбиваючи, розрізаючи або розламуючи той чи інший предмет.
Відновити зруйнований предмет простим складанням шматків не можна. Річ в тім, що сили притягання між молекулами речовини виявляються лише на дуже малих відстанях. Складаючи частини розламаного предмета, за допомогою тісного дотику поверхонь, при якому починають проявлятися сили притягання між молекулами, вдається досягти лише в порівняно невеликій кількості точок, і тому сил зчеплення недостатньо для з’єднання частин тіла. Щоб домогтися такого з’єднання, слід збільшити кількість точок дотику шматків, а для цього їх поверхні слід зробити дуже гладенькими або м’якими. Тоді, притискуючи шматки один до одного, можна зблизити їх так, що почне діяти притягання молекул.
Сили притягання залежать від природи молекул. Для склеювання різних матеріалів застосовуються речовини, молекули яких сильно взаємодіють з частинками склеюваних матеріалів. Молекули клею легко сблизити з молекулами твердого тіла настільки, щоб між ними виникли сили взаємного притягання. Вченими створено полімерні клеї холодного твердення, які склеюють метал, бетон, тканини. Склеєні деталі витримують тиск порядку
12 х 1012 Па і температуру від –60 до +1200 С.
Між молекулами діють також і сили відштовхування. На це вказуює, зокрема, мала стискуваність твердих сил і рідин. Адже сили притягання між частинками мають сприяти стисканню тіла, а між тим, щоб стиснути чи спресувати тіло, до нього слід прикласти силу, і часто дуже велику. Отже, між молекулами діють і сили відштовхування.
Сили притягання і відштовхування існують одночасно, проте залежать від відстаней між частинками по-різному.
 |
 мал. 2
мал. 2
Залежність сил взаємодії молекул F від відстані між ними подамо графічно (мал. 1), вважаючи сили відштовхування додатними, а сили притягання – від’ємними. Нехай одна з молекул міститься в початку координат, а друга на деякій відстані r від неї (в точці А). Між ними діє дуже мала сила взаємного притягання і ще менша сила відштовхування. В міру зближення молекул, швидше зростатиме сила притягання. На відстані r0 що дорівнює приблизно сумі радіусів молекул, сила притягання виявляється рівною силі відштовхування. Ця відстань ОВ =r0 відповідає положенню стійкої рівноваги молекул і називається рівноважною. При подальшому зближенні молекул (r < r0) сила відштовхування переважає силу притягання.
На графіку показано залежність рівнодійної сил взаємодії двох частинок від відстані між ними. Кожна координата цієї кривої, яка відповідає будь-якій відстані r, утворюється внаслідок алгебраїчного додавання ординат двох перших кривих. Крива зміни сили взаємодії молекул показує, що, коли r>r0 , переважають сили взаємного притягання, а для r<r0 – сили відштовхування. Це легко пояснює виникнення сил пружності під час деформації тіл.
Якщо стискати тіло (зближати молекули на відстань, меншу від r0), то виникає сила, яка перешкоджає розтягуванню і повертає частинки після припинення зовнішнього впливу в початкове положення. У таблиці 1 надані східність та різниця агрегатних станів речовин (додаток 1). За відсутності теплового руху всі молекули речовин розташовувалися б одна біля одної на рівноважній відстані. В газі тепловий рух розкидає молекули далеко одну від одної. Частинки рідини розміщені компактніше, ніж частинки газу, проте тепловий рух теж збільшує проміжки між ними. При цьому сили притягання ще великі. У твердому тілі тепловий рух недостатній, щоб відірвати одну молекулу від іншої. В цьому випадку частинки здійстюють тепловий рух – коливання навколо центрів, що містяться один від одного на рівноважній відстані r0 , різній для різних речовин.
4. Маса і розміри молекул.
Сучасні методи вимірювання дають змогу визначити розміри молекул і атомів, які приблизно однакові для молекул кожної речовини. Наприклад, лінійні розміри молекул кисню становлять »3 х 10-10 м, води – близько 2,6 х 10-10 м.
Маси молекул та атомів виражаються дуже малими числами. Наприклад, маса молекули кисню дорівнює 53,5 х 10-27 кг, водню – 3,34 х 10-27 кг, вуглецю – 1,995 х 10-26 кг. На практиці користуватися такими числами незручно. Тому за одиницю вимірювання маси атомів і молекул прийнято атомну одиницю маси (а.о.м). Атомну одиницю обрали так, щоб маса найбільш поширеного ізотопу вуглецю була точно в 12 разів більша за цю одиницю, тобто
1 а.о.м. = 1/12 х mc = 1/12 х 1,995 х 10-26 кг = 1,66 х 10-27кг
Масу атома, виражену в а.о.м., називають відносною атомною масою Мr
Відносною атомною масою речовини Мr називають відношення маси атома m0 даної речовини до 1/12 маси атома вуглецю mc:

Відносна атомна маса магнію дорівнює 24. Це означає, що маса атому магнію у 24 рази більша за 1/12 маси атома вуглецю.
Відносні атомні маси елементів наведені у періодичній таблиці Менделєєва. Якщо речовина складається не з атомів, а з молекул, то її відносна молекулярна маса Mr дорівнює сумі відносніх атомних мас атомів, які утворюють молекулу. Наприклад, відносна молекулярна маса вуглекислого газу СО2 дорівнює 44.
Масу молекули будь-якої речовини можна визначити за формулою
m0 = 1,66 х 10-27 кг х Мr,

де m0 - маса молекули (в кг.), mr - відносна молекулярна маса цієї речовини.
Розміри і маси молекул дуже малі, тому кількість їх у будь-якому макроскопічному тілі величезна. Наприклад, у краплі води масою 1г 3,3 х 1022 молекул води. Це величезне число, тому зручніше вказувати не абсолютну кількість атомів чи молекул в тілі, а відносну, яку називають кількістю речовини.
Кількістю речовини n називають відношення числа молекул N у данному тілі до числа NА в 0,012 кг вуглецю:
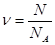
Вимірюють кількість речовини в молях.
Моль – кількість речовини, яка містить стільки ж молекул, скількі міститься атомів в 0,012 кг вуглецю.
Наприклад, 1 моль водню (H2) міститься в 2г водню, 1 моль кисню (О2) – в 32г кисню, 1 моль води (Н2О) – в 18 г води. Поряд з молем вживають кіломоль: 1 кмоль=103 моль.
Масу 1 моля речовини називають молярною масою і позначають М. Одиницею молярної маси є 1кг/моль.
Число молекул чи атомів в молі будь-якої речовини однакове і дорівнює
NA = 6,02 x 1023 моль-1.
Це число називають сталою Авогадро на честь італійського вченого Амадео Авогадро.
5. Швидкість молекул газу.
Вивчення дифузії і броунівського руху дає змогу дістати деяке уявлення про швидкість хаотичного руху молекул газу. При зіткненнях молекул змінюються не лише напрями руху молекул, а й модулі їх швидкостей. Зіткнення супроводжуються всіма можливими змінами швидкостей і приводять до певного статистичного розподілу молекул за швидкостями.
Задача про розподіл молекул за швидкостями була поставлена теоретично англійським вченим Максвеллом засобами теорії ймовірності. Закон розподілу молекул за швидкосями молекул визначає кількість молекул, швидкості яких лежать у певному інтервалі значень швидкості.
Форма закону Максвелла зображена графічно на малюнку 2. Вздовж осі абсцис відкладено можливі швидкості руху молекул деякого газу при певній температурі. На осі ординат відкладена відносна кількість молекул, швидкість яких лежить в інтервалі від v до v+Dv, тобто число Dn/Dv. Відношення Dn/Dv вказує розподіл числа молекул за швидкостями; Dn/Dv залежить від швидкості і називається функцієй розподілу кількості молекул за швидкостями.
 Dn/Dv
Dn/Dv
 |
v0 v u Du v
мал.2
Графічно розподіл має вигляд кривої лінії, яка проходить через початок координат і досягає максимума при v=vv (найбільш ймовірна швидкість), а потім асимптотично наближається до вісі абсцис. Графік наочно показує, що молекул з малими і великими швидкостями мало і що більшість молекул має швидкості, які наближуються до найбільш ймовірної швидкості.
Для експериментальної перевірки закону Максвела німецький фізик Штерн здійснив спеціальний дослід. Прибор Штерна складався з двох жорстко скріплених між собою порожнистих коаксіальних циліндрів, по осі яких натягувалася покрита сріблом платинова дротина. У приладі створювався високий вакуум. Внутрішній циліндр мав дуже вузьку вертикальну щілину. Під час нагріву дротини струмом до температури 1000С срібло починало випаровуватись і внутрішній циліндр наповнювався атомами срібла. Ті атоми, які летіли від дротини вздовж радіуса до щілини, вилітали в зовнішній циліндр та осідали на його внутрішній поверхні, утворюючи вузеньку срібну смужку – проекцію щілини.
Така картина утворювалася б при нерухомому приладі. Але Штерн приводив прилад в обертання з кутовою швидкістю w. Тому атоми срібла осідали позаду щілини (відносно напряму обертання). На поверхні зовнішнього циліндру утворювалась не вузенька срібна смужка, а широка смуга аb неоднакової товщини, показана у розрізі на мал. 3. Смужка утворювалась широкою тому, що різні атоми мали різні швидкості: найбільш швидкі атоми осідали ближче до початку полоси а, найменш швидкі- ближче до кінця b. Неоднаковість товщини смуги пов’язана з тим, що на різні швидкості руху атомів припадає різна кількість атомів: тим місцям смуги, де вона тонша, відповідають швидкості, яким відповідає менша кількість атомів.
w
 | |||
 |

r
 |

 v
v
мал. 3
Таким чином, кожне місце на розрізі смуги відповідає деякій швидкості і деякій кількості осівших атомів, а вид поперечного розрізу смуги характеризує розподіл кількості атомів за швидкостями. Слід звернути увагу на велику схожість видів максвеллівського графіка і розрізу срібної смуги, що є якісним підтвердженням закону Максвелла. В дослідах Штерна циліндри оберталися зі швидкістю 1500 – 2700 об/хв, зміщення смужки становило при цьому 0,035 – 0,063 см, ширина її в нерухомому приладі була приблизно 0,4мм. Обчислена за цими даними середня швидкість теплового руху атомів срібла дорівнювала близько 600м/с.
Питання для самоконтролю.
1. Наведіть факти, які свідчать про подільність речовини.
2. Сформулюйте основні положення молекулярно-кінетичної теорії будови речовини.
3. Які спостереження з свого повсякденного життя ви можете навести, щоб підтвердити наявність міжмолекулярних проміжків?
4. У чому полягає явище дифузії?
5. Як можна спостерігати дифузію в газах, рідинах і твердих тілах?
6. Чому при підвищенні температури зростає швидкість дифузії?
7. У чому полягає броунівський рух?
8. Чому броунівський рух не спостерігається у великих частинок речовини, завислих у рідині чи газі?
9. Які досліди підтверджують, що між молекулами твердих і рідких тіл діють сили притягання і відштовхування?
10. Поясніть, у чому полягає склеювання, зварювання і пресування металів.
11. Поясніть виникнення сил пружньості в твердих тілах під час розтягування і стискання.
12. Скориставшись таблицею Менделєєва, визначте відносну молекулярну масу кисню О2, метану СН4, сірководню Н2S.
13. Визначити масу молекули кисню, метану і сірководню
14. Скільки молів міститься в 45г води?
15. Розрахуйте молярну масу кисню, метану і сірководню.
16. Скільки молекул містять 2г водяної пари?
17. Чому в досліді Штерна повітря з циліндрів відкачувалося до високого вакууму?
18. Зображення щілини в досліді Штерна виявлялося розмитим. Про що це свідчить?
19.
Лекція №4
Тема: Основи молекулярно-кінетичної теорії (МКТ).
Мета: Ознайомити студентів з поняттям ідеального газу, температури і тиску на основі молекулярних уявлень, з основним рівнянням молекулярно-кінетичної теорії газів.
Оснащення: Схема, опорні конспекти.
План лекції.
1. Поняття про ідеальний газ.
2. Характеристика газоподібного стану речовини.
3. Основне рівняння молекулярно-кінетичної теорії газів.
Література.
1. Гончаренко С.У. Фізика: Пробн. навч. посібник для ліцеїв та класів природничо-наукового профілю. 10 кл. – К.:Освіта, 1995.-430с; с…29-40
2. Л.С.Жданов, Г.Л.Жданов. Фізика для середніх спеціальних навчальних закладів, К., Вища школа, 1985, с.38… 40
3. Физика: Школьнй курс. – М.:АСТ – Пресс, 2000, с.296… 297
Зміст лекції.
1. Поняття про ідеальний газ.При вивченні явищ у природі і техніці не можна врахувати всіх факторів, які впливають на хід того чи іншого явища. Однак, з досліду завжди можна встановити найважливіші з них. Тоді всіма іншими факторами, які не мають суттєвого впливу на хід явища, можна знехтувати. На цій основі створюється ідеалізоване, тобто спрощене уявлення про таке явище. Потім теоретично вивчають хід явища в ідеальних умовах, тобто при дії тільки найважливіших факторів. Створена на цій основі модель явища допомагає вивчати процеси, що відбуваються реально, і передбачати їх хід у ціх випадках.
При описанні процессів в газах використовують модель реального газу – ідеальній газ.
Основні властивості ідеального газу:
а) Молекули ідеального газу мають мізерно малі розміри у порівнянні з середньою відстанню між ними.
б) Молекули ідеального газу розглядають як дуже малі пружні кульки, що мають масу, тобто молекули ідеального газу – матеріальні точки.
в) Силами притягання між молекулами можна знехтувати, сили відштовхування з’являються лише тоді, коли молекули внаслідок теплового руху наближаються одна до одної на відстань, яку можна порівняти з діаметром саміх молекул.
г) Кількість співударів між молекулами мізерно мала в порівнянні з кількістю їх ударів об стінку посудини.
д) В ідеальному газі потенціальною енергією молекул можна знехтувати, враховується тільки середня кінетична енергія поступального руху частинок.
Таким чином, ідеальним газом називають такий газ, молекули якого пружні матеріальні точки, не зв’язані між собою міжмолекулярними силами зчеплення.
2. Характеристика газоподібного стану речовини
Головну роль у поведінці газу відіграє хаотичний рух його молекул, який є тепловим рухом. Для характеристики теплового руху використовують поняття температури – фізичної величини, яка кількісно описує інтенсивніть хаотичного руху його молекул.
Температура тіла і швидкість руху його молекул тісно пов’язані між собою. Чим вища температура тіла, тим швидше рухаються його молекули, тим більша їх кінетична енергія. Таким чином, кінетичну енергію молекул, як і температуру, можна розглядати як міру теплового руху молекул.
Якщо масу молекули тіла позначити m, а швидкість її поступального руху v, то кінетична енергія поступального руху молекули
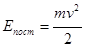 .
.
Молекули тіла можуть мати різні швидкості і величину Епост, тому для характеристики стану тіла використовують середню кінетичну енергію поступального руху `Епост.

де N – загальне число молекул у тілі. Якщо всі молекули однакові, то
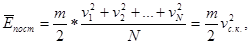
Тут через vc.к. позначено середню квадратичну швидкість хаотичного руху молекул:
Якщо привести два гази з різними значеннями середньої кінетичної енергії молекул до зіткнення, то через певний час середні кінетичні енергії їх молекул стануть однаковими, оскільки, стикаючись одна з одною, молекули газів обмінюються енергією. Так само поводяться тіла з різною температурою. Під час їх зіткнення енергія передається теж від одного з них до другого доти, поки не зрівняються їх температури. З цього порівняння випливає, що температура може служити мірою середньої кінетичної енергії молекул газу.
У фізиці використовують дві шкали температур: шкала Цельсія за іменем шведського астронома Цельсія і абсолютна температурна шкала, або шкала Кельвіна, в якій температура замерзання води прийнята равною 273,15 , а кипіння – 373,15 градуса. За градус приймають одну соту різниці між температурами кипіння і замерзання чистої води при атмосферному тиску.
Між абсолютною температурою T і температурою за Цельсієм t 0 існує таке співвідношення:
Т = t 0 + 273
Температуру, що дорівнює нулю за шкалою Кельвіна, називають абсолютним нулем, йому відповідає –273,150 С.
Досліди і розрахунки показують, що середня кінетична енергія поступального руху молекул `Епост пропорційна абсолютній температурі газу Т. У випадку ідеального газу зв’язок між цими величинами виражається формулою:
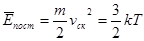
Коефіцієнт k називають сталою Больцмана. Він показує, на скільки зміниться кінетична енергія однієї молекули на один градус. Числове значення сталої Больцмана знайдене експериментально, k = 1,38 x 10-23 Дж/К.
З останньої формули випливає, що абсолютним нулем є температура, при якій середня кінетична енергія поступального руху молекул дорівнює нулю. Але це не означає, що при абсолютному нулі припиняється будь-який рух молекул. Навіть при абсолютному нулю молекулярний рух не припиняється, молекули здійснюють коливальні рухи.
Замість розпливчастого поняття температури як “ступеня нагрітості”тіла, яке використовують у повсякденному житті, ми дістали чітке означення : температура – це міра середньої кінетичної енергії руху молекул. Цей висновок справедливий не тільки для ідеального газу, а й для речовини в будь-якому стані.
Не можна говорити про температури однієї або кількох молекул, про “гарячі” й “холодні” молекули Температура – це макроскопічна величина, яка характеризує стан величезної кількості молекул.
3. Основне рівняння молекулярно-кінетичної теорії газів.
Тиск газу на стінку посудини зумовлений ударами молекул. Чим більша кінетична енергія поступального руху кожної молекули, тим більша сила, яка виникає при ударі молекули об стінку. Крім того, чим більше молекул в одиниці об’єму n0, тим частіше вони будуть ударятися об стінку. Тому тиск газу прямо пропорційний середній кінетичній енергії поступального руху молекул газу та числу її в одиниці об’єму:
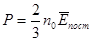
Ця формула називається основним рівнянням молекулярно-кінетичної теорії газів. Виведемо цю формулу. Візьмемо посудину у формі куба з ребром l. Припустимо, що всередині куба в кожній одиниці об'єму є n0 однакових молекул газу. Оскільки молекули рухаються, то кожна з них має кількість руху (імпульс) 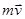 (тут m – маса однієї молекули, v – швидкість її руху). Вважатимемо удари молекул об стінки абсолютно пружними. Тоді, якщо молекула рухається перпендикулярно до стінки посудини, то при ударі вона спочатку зупиняється, тобто втрачає імпульс
(тут m – маса однієї молекули, v – швидкість її руху). Вважатимемо удари молекул об стінки абсолютно пружними. Тоді, якщо молекула рухається перпендикулярно до стінки посудини, то при ударі вона спочатку зупиняється, тобто втрачає імпульс 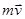 , а потім відскакує від стінки і рухається в протилежний бік із швидкістю -`v, тобто набуває протилежно напрямленого імпульсу -
, а потім відскакує від стінки і рухається в протилежний бік із швидкістю -`v, тобто набуває протилежно напрямленого імпульсу -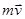 . Отже, зміна імпульсу молекули в процесі удару дорівнює 2mv, а стінка набуває такого самого за модулем імпульсу 2mv.
. Отже, зміна імпульсу молекули в процесі удару дорівнює 2mv, а стінка набуває такого самого за модулем імпульсу 2mv.
Нехай ця молекула бесперешкодно рухається між лівою і правою стінками куба. При кожному ударі вона надає стінці імпульсу 2mv. Відповідно до законів механіки, середня сила дії молекули на стінку дорівнює:
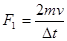 ,
,
де Dt – час руху молекули від однієї стінки до другої і назад, тобто Dt=2l/v , оскільки молекула наносить стінці удари з таким проміжком часу. Отже,
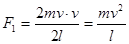
Сила тиску газу на стінку посудини дорівнює сумі сил ударів окремих молекул об цю стінку:
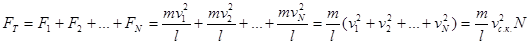 ,
,
де N – загальне число молекул, які літають між двома протилежними стінками куба, а vс.к. – середня квадратична швидкість молекул.
Оскільки число молекул в одиниці об’єму дорівнює n0, то сумарне число молекул в кубі дорівнює n0 l3/ . Внаслідок повної хаотичності руху молекул для кожної з них всі напрями руху рівноймовірні. Тому можна вважати, що вздовж трьох взаємно перпендикулярних напрямів рухається 1/3 загального числа молекул. Отже, для обчислення тиску можна вважати, що між двома протилежними стінками куба вздовж перпендикуляра до них рухається 1/3 загального числа молекул, тобто  . Отже,
. Отже,
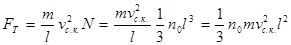
Оскільки р = FT / S = FT / l2 , дістаємо

Через те що mv2с.к./ 2 = `Eпост., остаточно маємо:
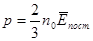
Питання для самоконтролю.
1. Для чого вводять поняття ідеального газу?
2. Які властивості приписують ідеальному газу?
3. Який зв’язок існує між температурою і середньою кінетичною енергією поступального руху молекул газу?
4. Чи правильним є ствердження, що при абсолютному нулі температури припиняється будь-який рух частинок?
5. Як обчислити зміну імпульсу молекули при ударі в стінку посудини?
6. Між якими величинами встановлює зв’язок основне рівняння молекулярно-кінетичної теорії газів?
Лекція №5
Тема: Основи молекулярно-кінетичної теорії (МКТ).
Мета: Ознайомити студентів з експериментальними газовими законами, з рівнянням Клапейрона (об’єднаним газовим законом) та рівнянням Менделєєва-Клапейрона.
Оснащення: Таблиці, опорні конспекти.
План лекції.
1. Експериментальні газові закони: закон Бойля-Маріотта, Гей-Люссака, Шарля, Дальтона, Авогадро.
2. Рівняння Клапейрона, Менделєєва-Клапейрона. Універсальна газова стала.
3. Середня кінетична енергія поступального руху молекули ідеального газу. Число Лошмідта.
Література.
1. Гончаренко С.У. Фізика: Пробн. навч. посібник для ліцеїв та класів природничо-наукового профілю. 10 кл. – К.:Освіта, 1995.-430с; с…40-46
2. Л.С.Жданов, Г.Л.Жданов. Фізика для середніх спеціальних навчальних закладів, К., Вища школа, 1985, с.40… 51
Зміст лекції.
1. Експериментальні газові закони: закон Бойля-Маріотта, Гей-Люссака, Шарля, Дальтона, Авогадро.
Газові закони були встановлені експериментально задовго до появи молекулярно-кінетичної теорії, на дослідах з газами, що знаходяться в умовах, які не дуже відрізняються від нормальних атмосферних умов, тобто при не дуже низьких температурах і не дуже високому тиску.
Стан даної маси газу прийнято характеризувати такими фізичними величинами (параметрами стану): тиском Р, об’ємом V та температурою T.
Зміна стану газу, що супроводжується зміною усіх або деяких з цих величин, називається газовим процесом. Процеси, під час яких маса газу і один з його параметрів є сталими, називаються ізопроцесами (від грецького “ізос” – рівний, однаковий). Оскільки є три параметри газу, існує три різні ізопроцеси: ізотермічний, ізобарний та ізохорний.
Закон Бойля-Маріотта.
Процес, який відбувається у газі, при сталій температурі, називається ізотермічним. Математично ізотермічний процес можна описати виразом:
Р=f(V) при m=const T=const
Ізотермічний процес у газі детально вивчили англійський вчений Р.Бойль та французський фізик Е. Маріотт, які незалежно один від одного встановили, що добуток об’єму газу на його тиск є величина стала:
P V = const, при m = const, T = const.
Для двох станів газу: при сталій масі газу і незмінній температурі тиск газу обернено пропорційний його об’єму:
P1 V1 = P2 V2, або 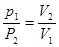
Ці формули є матетатичним виразом закону Бойля-Маріотта.
Читайте також:
- V. Етичні правила психологічних досліджень
- А ви слідуєте цім правилам, коли виступаєте публічно?
- Види графіків та правила їх побудови.
- Визначення, класифікація і правила побудови індексів
- Вимоги до керівника, правила та принцинципи управління
- Відомості про правила охорони і техніки безпеки на підземних гірничих роботах.
- Встановлення відношень між судженнями за правилами логічного квадрата.
- Групова дискусія та правила її проведення
- Дедуктивний умовивід та його правила
- Довідки - їхні види та правила оформлення
- ДОКУМЕНТАЦІЯ. ЗВІТИ У СФЕРІ НАУКИ І ТЕХНІКИ. Структура і правила оформлення
- Етикетні правила поведінки в мовленні
| <== попередня сторінка | | | наступна сторінка ==> |
| Розділ 3. Спосіб осмислення біографічної особистості в | | | Закон Шарля |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |