
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Обладнання
уроку: Схематичні засоби: малюнки просторових моделей структурної організації
білків «Первинна структура білка», «Вторинна структура білка», «Третинна
структура білка», «Четвертинна структура білка», записи на дошці «Загальна
формула амінокислоти», «Формула пептидного зв’язку», портрет Антуана
Франсуа де Фуркруа, записи на дошці (загальна формула поліпептиду, базові
терміни, властивості білків та ін..);
Друковані засоби: підручник.
Роздатковий матеріал: «Рівні структурної організації білків» і «Замінні та
незамінні амінокислоти» (20 екз.+1 для викладача)
Хід уроку
І. Організаційний початку уроку (1-2 хв.)
1.1. Привітання вчителя
1.2. Фіксація відсутніх учнів
1.3. Перевірка готовності учнів до уроку
ІІ. Перевірка виконання учнями домашнього завдання практичного характеру (4-5 хв.)
2.1. Опитування біля дошки
- Які речовини відносять до ліпідів?
- Яку будову має більшість ліпідів?
- Які клітини і тканини найбільш багаті на ліпіди?
- Який зміст і будову мають молекули вуглеводів?
- Які вуглеводи називають моно-, ди- і полісахаридами?
-
2.2. Перевірка зошитів на наявність виконаного домашнього завдання.
ІІІ. Актуалізація опорних знань (6 хв.)
3.1. Питання для активізації пам’яті
- Що таке макромолекули, мономери і полімери?
- У 9 класі ми знайомились з органічними речовинами клітини, в тому числі, і з білками.
- Чи знаєте ви, що таке білки?
- Що ви знаєте про білки?
- Пригадайте рівні організації білкової молекули?
ІV. Мотивація навчальної діяльності школярів та повідомлення теми, мети і задач уроку (2-3 хв.)
- Як ви вже здогадались, тема нашого уроку: «Білки: будова і властивості». Сьогодні на уроці ми повинні з'ясувати, що таке білки, яку вони мають будову, які мають властивості і яку роль в організмі вони виконують.
- Чи потрібні організму тварини білки?
V. Сприймання і усвідомлення учнями нового навчального матеріалу (5-10 хв.)
5.1. Розповідь вчителя з елементами евристичної бесіди.
План вивчення нового матеріалу
1. Поняття «білки». Будова білкових молекул.
2. Амінокислоти. Загальна формула амінокислот та класифікація.
3. Коротка історія дослідження білків. Пептид і пептидний зв'язок.
4. Рівні організації білкових молекул
5. Властивості білків: денатурація, ренатурація, деструкція.
6. Класифікація білків.
7. Роль білків в життєдіяльності організмів.
1. Поняття «білки». Будова білкових молекул.
Білки – це високомолекулярні біополімери, мономерами яких є залишки амінокислот. (a-амінокислоти). До складу білків входять: С, Н, О, N, S. Частина білків утворює комплекси з іншими молекулами, які мають у складі фосфор, залізо, цинк и мідь. До складу білків входять 20 різних амінокислот,.
- Як досягається тоді величезна різноманітність білків?
До складу білків входять 20 різних амінокислот, звідси отримуємо величезну різноманітність білків завдяки різним комбінаціям амінокислот.
Як з 33 букв абетки ми можемо скласти нескінченну кількість слів, так і з 20 амінокислот – нескінченну множину білків.
- Як ви вважаєте, чи є важливою постійність складу амінокислот, які входять до білкової молекули? Чому?
Кожен білок характеризується постійним складом амінокислотних залишків та їхньою певною послідовністю. Для позначення амінокислот в науковій літературі використовуються одно- або трьохбуквені скорочення. Хоча на перший погляд може здатися, що використання «всього» 20 основних типів амінокислот обмежує різноманітність білкових структур, насправді кількість варіантів важко переоцінити: для ланцюжка всього з 5 амінокислот воно складає вже більше 3 мільйонів, а ланцюжок з 100 амінокислот (невеликий білок) може бути представлений більш ніж у 10130 варіантах (для порівняння — кількість атомів у Всесвіті оцінюється приблизно у 1080). Потенційне різноманіття білків дуже велике – кожному білку відповідає своя особлива послідовність амінокислот, контрольована генетично. Білків припадає на частку близько половини сухої маси клітки. Двадцять амінокислот, залишки яких входять до складу білків, називають основними. (використання таблиць на дошці)
2. Амінокислоти. Загальна формула амінокислот та класифікація.
Ми кажемо про амінокислоти. А що ж таке амінокислота?
- Це органічні сполуки, які містять аміногрупу (-NH2) та карбоксильну групу (-COOH), і відрізняються одна від одної радикалом.
- Які властивості забезпечує аміногрупа у складі амінокислот? (лужні)
- Які властивості забезпечує карбоксильна група? (кислотні)
- Як називаються сполуки, які проявляють і кислотні, і лужні властивості?
- Отже, амінокислоти відносимо до яких сполук? (амфотерних сполук)
- Амінокислоти відрізняються одна від одної за радикалом. А що таке радикал?
- Групи атомів, за якими амінокислоти розрізняються між собою, називають радикалами, або R-групами.
Існують різні класифікації амінокислот. Зокрема, їх поділяють на замінні та незамінні. Замінні амінокислоти можуть синтезуватися в організмі людини і тварин з продуктів обміну речовин. Натомість незамінні амінокислоти в організмі людини і тварин не синтезуються. Вони надходять разом з їжею. Їх синтезують рослини, гриби, бактерії. Білки, які містять усі незамінні амінокислоти, називають повноцінними, на відміну від неповноцінних, до складу яких не входять ті чи інші незамінні амінокислоти. (використання схем (роздатковий матеріал) «Замінні та незамінні амінокислоти»)
- В організмі людини нараховується до 100 000 білків. Білки поділяють на протеїни (прості білки) і протеїди (складні білки). Число амінокислотних залишків, які входять до молекули білка, різниться: інсулін – 51, міоглобулін – 140. Звідси маса Mr білка від 10 000 до декількох мільйонів.
- Амінокислота – це мономер білкової молекули. Молекули білків мають великі розміри, тому їх називають макромолекулами. Білки утворюються на рибосомах, ЕПС, цитоплазмі. (використання таблиць на дошці та роздаткового матеріалу)
Загальна формула амінокислот:
 NH2-CH-COOH
NH2-CH-COOH
R
3. Коротка історія дослідження білків. Пептид і пептидний зв'язок.
R може змінюватись у різних амінокислот. Через карбоксильна і аміногрупу відбувається з’єднання амінокислот при утворенні білка. Під час реакції полімеризації відбувається виділення молекули води, а вивільнені при цьому електрони утворюють міцний ковалентний зв'язок між карбоксильною групою однієї амінокислоти і аміногрупою іншої. Такий тип зв’язку називають пептидним (від грец. пептос – зварений). Структури, які складаються із кількості амінокислотних залишків, називають поліпептидами.
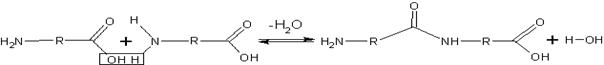
(запис на дошці)
Амінокислоти - амфотерні сполуки, тому вони в змозі взаємодіяти одна з одною, утворюючи поліпептидний ланцюг.
Пептидний зв’язок – ковалентний зв’язок, який утворюється між азотом аміногрупи однієї амінокислоти і вуглецем карбоксильної групи іншої амінокислоти
Поліпептиди з високою молекулярною масою (понад 6000) називають білками. Вони складаються з одного або кількох поліпептидних ланцюгів, які можуть містити до кількох тисяч амінокислотних залишків. (використання таблиць та записів на дошці)
Білки були виділені в окремий клас біологічних молекул в XVIII столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати при нагріванні або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.
У 2006 році Банк даних білків (Protein Data Bank) містив біля 40 000 структур білків. В наш час кріоелектрона мікроскопія великих білкових комплексів за роздільною здатністю наближається до атомного рівня. Особливістю досліджень білків початку XXI-го століття є одночасне отримання даних про білковий склад цілих клітин, тканин або організмів — протеоміка.
Перша гіпотеза про будову молекули білка була запропонована в 70-х роках XIX. Це була уреїдна теорія будови білка. В 1903 році німецький вчений Е. Г. Фішер запропонував пептидну теорію, яка стала ключем до розкриття тайни будови білка. Фішер допустив, що білки є полімерами із залишків амінокислот, з’єднаних пептидним зв’язком NH-CO. Ідея про те, що білки – це полімерні утворення, висувалася ще в 1888 році російським вченим А.Я. Данилевським. Саме ця теорія отримала підтвердження в наступних роботах.
4. Рівні організації білкових молекул
Згідно з цією поліпептидною теорією білки мають визначену структуру-рівні організації білкових молекул.
- Розкажіть, які ви пам’ятаєте рівні структурної організації білків?
Відомо 4 рівні структурної організації білків: первинний, вторинний, третинний і четвертинний. (використання таблиць на дошці та роздаткового матеріалу)
Первинна структура
білків визначається якісним і кількісним складом амінокислотних залишків, а також їхньою послідовністю. Послідовність амінокислот в поліпептидному ланцюзі являє собою первинну структуру білкової молекули.
Тип зв’язків – пептидні –NH-CO-. Часто молекула у вигляді ланцюга, складеного з амінокислотних залишків, нездатна виконувати специфічні функції. Для цього вона має набути складнішої просторової структури. Первинна структура інсуліну була відкрита Ф. Сенгером в 1944–54 роках; в даний час відома первинна структура декількох сотень білків. Послідовність амінокислот визначає біологічну функцію білка, і заміна однієї єдиної амінокислоти може різко змінити цю функцію. (заповнення учнями таблиці «Рівні структурної організації білкової молекули» в зошитах)
Вторинна структура
Зазвичай білкова молекула має форму спіралі. Закручування поліпептидного лінійного ланцюгу в спіраль. вторинна структура, що стабілізується водневими зв'язками, які виникають між CO- і NH-группами. На один виток спіралі доводиться 3,6 амінокислотного залишку. Існують і інші форми вторинної структури, наприклад, потрійна спіраль колагену і складчастий шар фібрину. (заповнення учнями таблиці «Рівні структурної організації білкової молекули» в зошитах)
Третинна структура
Дисульфідні, іонні і водневі зв'язки, а також гідрофобна взаємодія примушують більшість білкових ланцюгів згортатися в компактну глобулу. Це так звана третинна структура білка. (заповнення учнями таблиці «Рівні структурної організації білкової молекули» в зошитах)
Четвертинна структура
Нарешті, багато білків з особливо складною будовою складаються з декількох поліпептидних ланцюгів – спосіб їх упаковки називається четвертинною структурою. Стабілізація четвертинної структури досягається гідрофобними, електростатистичними та іншими взаємодіями, а також водневими зв’язками. (заповнення учнями таблиці «Рівні структурної організації білкової молекули» в зошитах)
5. Властивості білків: денатурація, ренатурація, деструкція.
Функціональні властивості білків, крім їхнього амінокислотного складу, зумовлені також і послідовністю амінокислотних залишків у поліпептидному ланцюзі та його просторовою структурою.
Одна з основних властивостей білків – їхня здатність під впливом різних факторів (дія концентрованих кислот і лугів, важких металів, високої температури тощо) змінювати свою структуру і властивості. Процес порушення природної структури білків, який супроводжується розгортанням поліпептидного ланцюга без зміни його первинної структури, називається денатурацією. (від лат. де – префікс, який означає втрату, і натура – природні властивості). Як правило, денатурація має незворотній характер. Проте на початкових стадіях денатурації за умови припинення дії факторів, що спричиняють цей процес, білок може відновити свій початковий стан. Це явище має назву ренатурації (від лат. ре - префікс, який означає поновлення).
- Які фактори спричинюють зворотню денатурацію? (температура, рН)
- Чому виникає денатурація? (Зв’язки з другого рівня слабші за ковалентні)
- До якого рівня денатурація обернена і чому? (До другого, так як розірваний ланцюг не відновлюється)
- Як ви вважаєте, денатурація може приносити користь організму?
У живих організмів відбувається часткова оборотна денатурація білків, пов’язана з виконанням ними певних функцій – забезпечення рухової активності, передачею в клітини сигналів з довкілля, прискорених біохімічних реакцій тощо. Денатурація має біологічне значення, наприклад, павук виділяє краплину секрету, яка прикріплюється до опори і продовжуючи виділяти секрет, павук натягує нитку-відбувається денатурація і секрет з розчиненого стану переходить у не розчинений.
Ряд причин (нагрівання, дія яких-небудь випромінювань, сильні кислоти і луги, важкі метали, органічні розчинники) можуть викликати денатурацію білка. Молекула тимчасово або постійно втрачає свою третинну структуру і «згортається» або випадає в осад. Використання спирту як дезинфекційного засобу пов'язане саме з тим, що він викликає денатурацію білка будь-яких бактерій.
Процес порушення первинної структури білків називають деструкцією (від лат. деструкціо – руйнування). Він завжди має необоротний характер.
6. Класифікація білків.
Класифікація білків украй ускладнена їх різноманіттям і складністю молекул. До простих білків, що складаються лише з амінокислот, відносять альбумін (яєчний альбумін і сироватковий альбумін крові), глобуліни (антитіла в крові, фібрин), гістони, склеропротеїни (кератин волосся, шкіри і пір'я, колаген сухожиль, еластин в'язок). До складних білків, що включають небілковий матеріал, відносять фосфопротеїни (казеїн молока, вітелін яєчного жовтка), глікопротеїни (плазма крові, муцин), нуклеопротеїни (хромосоми і рибосоми), хромопротеїни (гемоглобін, фітохром, цитохром), ліпопротеїни, флавопротеїни, металопротеїни.
За структурою білки поділяються на фібрилярні (третинна структура майже не виражена, нерозчинні, є довгі поліпептидні ланцюги), глобулярні (третинна структура добре виражена, розчинні) і проміжні (фібрилярні, але розчинні). Перші входять до складу сполучних тканин, другі відіграють роль ферментів, гормонів, антитіл.
Залежно від розчинності або нерозчинності у воді білки поділяють на гідрофільні та гідрофобні. Серед білків є активні у хімічному відношенні (наприклад, ферменти) і малоактивні. Деякі білки стійкі до дії різних факторів (наприклад, температури, хімічних чинників), інші – не стійкі. Наприклад, кератин, який входить до складу волосся, кігтів, нігтів, копит, здатний витримувати високу й низьку температуру. Натомість білок яйця птахів (овальбумін) при нагріванні змінює свою структуру.
7. Роль білків в життєдіяльності організмів.
Зміст білків в різних тканинах людини неоднаковий. М’язи містять до 80 % білку, селезінка, кров, легені – 72%, шкіра – 63 %, печінка – 57 %; мозок – 15 %, жирова тканина, костна і тканина і тканина зубів – 14-28 %. Білки – необхідні компоненти харчових продуктів, вони входять у склад лікарських препаратів.
VI. Узагальнення і систематизація знань (5-10 хв.).
6.1. Біологічний диктант
1. Головним носієм життя є … (білки);
2. … - це складні високомолекулярні сполуки, побудовані з … (білки; залишків a-амінокислот);
3. Елементний склад білків: … (С, Н, О, N, S);
4. Молекулярна маса білків вимірюється від … до … (10 тис, мільйонів);
5. Багато білків має здатність розчинюватися в … , та майже всі розчинюються у … (воді, розчинах солей, кислот, лугах)
6. Нерозчинні білки, з яких побудовані … (тканини живих організмів: шкіра, сухожилки, м’язи, нігті, волосся)
7. У структурі білка розрізняють рівні…(первинний, вторинний, третинний, четвертинний)
8. Основні властивості білків … (денатурація, ренатурація, деструкція)
9. Денатурація може бути зворотньою до … рівня (другого)
10. Процес порушення первинної структури білків називають … (деструкцією)
Критерії оцінювання:
«5» - всі відповіді правильні;
«4» - 1-2 невірні відповіді;
«3» - 3 невірні відповіді;
«2» - 4 і більше невірних відповідей.
VII. Домашнє завдання
Вивчити матеріал § 4, стор. 22-26.
Скласти (до оформити) таблицю «Рівні структурної організації білків», замалювати схематично рівні структурної організації білків, скласти кросворд на тему «Будова і властивості білків».
VIII. Підсумок уроку (1-2 хв.)
8.1. Підсумкова бесіда
- Що таке білки?
- Яка будова білків?
- Яка будова амінокислот?
- Що таке замінні та незамінні амінокислоти?
- Як амінокислоти сполучаються в поліпептидний ланцюг?
- Які ви знаєте рівні структурної організації білків?
- Які властивості притаманні білкам?
- Що спільного та відмінного в процесах денатурації та деструкції?
- Чим небезпечна для людини підвищена температура тіла при хворобі?
8.2. Оцінювання діяльності та активності учнів на уроці.
Читайте також:
- D) оснащення виробництва обладнанням, пристроями, інструментом, засобами контролю.
- Абонентське обладнання для відеоконференц-зв'язку
- Алгоритм розрахунку та підбору технологічного обладнання
- Аналіз використання обладнання.
- Аналіз службового призначення деталей та конструктивних елементів обладнання харчових виробництві, визначення технічних вимог і норм точності при їх виготовленні
- Апаратура, обладнання та матеріали
- Апаратура, обладнання та матеріали
- Безпечність технологічного обладнання
- Вибір вентиляційного обладнання
- Вибір електрообладнання на напругу до 1кВ.
- Види очисного обладнання та споруд
- Види та причини зношення електрообладнання
| <== попередня сторінка | | | наступна сторінка ==> |
| Структура топографо-геодезичного підприємства | | | Т. ГОББС. ДО ЧИТАЧА. ПРО ТІЛО |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |