
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Вторинні хімічні джерела постійного струму
До вторинних ХДС відносять ті, що дозволяють багаторазове використання за рахунок повторного заряджання розряджених елементів постійним струмом від зовнішнього джерела. Такі електрохімічні елементи називають акумуляторами, а з’єднання кількох акумуляторів - акумуляторною батареєю. Для збільшення напруги їх з’єднують послідовно, для збільшення струму - паралельно.
При під’єднанні до акумулятора споживача електричної енергії він працює як звичайний гальванічний елемент, в якому відбувається процес перетворення активних речовин в продукти розряджання. При заряджанні в акумуляторі створюють струм протилежного напряму, ніж при розряджанні, при цьому електрична енергія зовнішнього джерела перетворюється в хімічну енергію активних речовин, тобто відбувається процес регенерації продуктів розряджання в активні речовини.
Акумулятори поділяють на кислотні і лужні. В кислотних акумуляторах окислювачем є двоокис свинцю PbO2, відновлювачем - свинець Pb , електролітом 27...39 % розчин сірчаної кислоти H2SO4, тобто
(+) PbO2 |H2SO4| Pb (-) .
При розряджанні відбувається реакція
PbO2 + 2H2SO4 +Pb = 2PbSO4 + 2H2O
і сульфат свинцю PbSO4 є продуктом розряджання.
При заряджанні протікає зворотна реакція
2PbSO4 + 2H2O = PbO2 + 2H2SO4 + Pb.
При повністю зарядженому акумуляторі напруга холостого ходу Uо = 2,5...2,6В
Свинцеві акумулятори мають велику питому потужність ( 100...150 Вт/кг) і сталу напругу при розрядці, а тому їх використовують як стартерні для пуску двигунів внутрішнього згоряння.
Основними недоліками є недостатня питома енергія, участь електроліту в реакції, значне саморозряджання (3...10 % від початкової ємності за місяць), осідання на електродах солей свинцю, що має місце при зменшенні напруги нижче 1,8В (сульфатація електродів), які збільшують внутрішній опір і зменшують строк служби акумуляторів.
Основними параметрами кислотних акумуляторів є ємність Q, яка вимірюється в ампер-годинах; напруга U, B; номінальний (тривалий) Ін і максимальний (короткочасний) Іmax струми розряджання. Струм заряджання в амперах Із приймають не більше  . Краще заряджати струмом, величину якого розраховують за формулою
. Краще заряджати струмом, величину якого розраховують за формулою
Із = Q /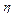
 tз ,
tз ,
де Q - ємність акумулятора; 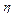 = 0,88 -коефіцієнт віддачі зарядженого акумулятора; tz - розрахунковий час заряджання (приймають 48 годин). Спочатку 36 годин заряджають розрахунковим струмом Із , потім 3 години перерви і знову 12 годин заряджають тим же струмом. Такий спосіб заряджання продовжує строк служби. Ще краще заряджати однопівперіодним випрямленим струмом, середнє значення якого за період не більше розрахункового Із з одночасним розряджанням між півперіодами струмом Ір = (0,1...0,2) Із .
= 0,88 -коефіцієнт віддачі зарядженого акумулятора; tz - розрахунковий час заряджання (приймають 48 годин). Спочатку 36 годин заряджають розрахунковим струмом Із , потім 3 години перерви і знову 12 годин заряджають тим же струмом. Такий спосіб заряджання продовжує строк служби. Ще краще заряджати однопівперіодним випрямленим струмом, середнє значення якого за період не більше розрахункового Із з одночасним розряджанням між півперіодами струмом Ір = (0,1...0,2) Із .
Промисловість виготовляє широкий асортимент кислотних акумуляторів на напругу 12 В. В скорочених назвах акумуляторних батарей першою цифрою позначають кількість послідовно з’єднаних акумуляторів, букви СТ означають, що це стартерна акумуляторна батарея, друга цифра вказує ємність акумуляторної батареї в ампер годинах.
годинах.
До лужних відносяться акумулятори, в яких електролітом є розчин гідроксиду калію KOH густиною 1190...1210 кг/м3 з добавкою моногідрату гідроксиду літію LiOH H2O густиною 20 кг/м3. За матеріалом електродів лужні акумулятори поділяють на нікель-кадмієві, нікель-залізні, срібно-цинкові, срібно-кадмієві та ін. Найбільше відомі і широко використовуються нікель-кадмієві акумулятори.
H2O густиною 20 кг/м3. За матеріалом електродів лужні акумулятори поділяють на нікель-кадмієві, нікель-залізні, срібно-цинкові, срібно-кадмієві та ін. Найбільше відомі і широко використовуються нікель-кадмієві акумулятори.
Процес розряджання і заряджання нікель-кадмієвих акумуляторів відбувається так:
2NiOOH + Cd + 2H2O + KOH = 2Hi(OH)2 + Cd(OH)2 + KOH .
Напруга холостого ходу Uo = 1,3...1,35 В. За номінальну прийнята напруга Uн = 1,15 В.
Оскільки в лужних акумуляторах електроліт не приймає участі в реакції, такі акумулятори мають стабільну напругу при розряджанні, значно більший ресурс - до 1000 циклів заряджання - розряджання.
Особливу групу лужних акумуляторів складають герметичні акумулятори, в яких ємність додатного електрода менша ємності від’ємного, тому кисень, який виділяється в кінці розряджання, витрачається на окислення кадмію і, як наслідок, тиск в акумуляторі не збільшується. Такі акумулятори використовують в побутовій радіоапаратурі, слухових апаратах і в інших пристроях як джерела живлення.
Заряджання лужних акумуляторів здійснюється струмом Із = на протязі 10...12 годин, оскільки перезаряджання їм не шкодить. Заряджання вважається закінченим, якщо напруга досягла 1,75...1,85B. Якщо при експлуатації акумулятора напруга менша 1,1В, акумулятор слід зарядити.
на протязі 10...12 годин, оскільки перезаряджання їм не шкодить. Заряджання вважається закінченим, якщо напруга досягла 1,75...1,85B. Якщо при експлуатації акумулятора напруга менша 1,1В, акумулятор слід зарядити.
Недоліком лужних акумуляторів є значний струм,саморозряджання і малий стартерний струм, який за величиною рівний приблизно ємності, тобто Iст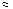 |Q|. Причиною цього є великий внутрішній опір.
|Q|. Причиною цього є великий внутрішній опір.
В скороченій назві лужних акумуляторів перші цифри вказують кількість ввімкнутих послідовно акумуляторів, наступні дві букви вказують матеріал електродів, наступні дві цифри вказують ємність в ампер-годинах, наприклад, 10НК55К - напруга 12,5 В, нікель-кадмієвий, ємність 55 ампер-годин, К – конструктивно-технологічна особливість.
Більшу енергетичну здатність, значно менший внутрішній опір і більшу напругу одного елемента 3,6 В мають літій-іонні акумулятори.
У них від’ємним можуть бути вугільний або графітовий електроди, а додатнім –діоксид кобальту з іонами літію 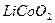 .
.
Читайте також:
- А джерелами фінансування державні капітальні вкладення поділяються на централізовані та децентралізовані.
- Автоматичне розвантаження по струму.
- Активний опір у ланцюзі синусоїдального струму
- Активність особистості та її джерела, спрямованість особистості
- Альтернативні джерела формування підприємницького капіталу
- АНАЛІЗ ОБОРОТНИХ АКТИВІВ ЗА ДЖЕРЕЛАМИ ЇХ ФОРМУВАННЯ
- Аналіз співвідношення активів із джерелами їх фінансування
- Антропогенне забруднення природного середовища. Джерела забруднень
- Антропологічні джерела
- Баланс потужностей у колі гармонічного струму.
- Банківське право України: поняття , предмет регулювання, джерела і система
- Безперебійні джерела живлення
| <== попередня сторінка | | | наступна сторінка ==> |
| Первинні хімічні джерела струму | | | Основні параметри ХДС |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |