
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Процеси, у яких вихідні речовини перетворюються у продукти реакції за рахунок регулярного чергування реакцій з участю радикалів, називаються ланцюговими процесами (реакціями).
Класичний приклад ланцюгової реакції – взаємодія хлору з воднем під дією світла. Брутто реакція має вигляд:
Н2 + Cl2  2HCl.
2HCl.
Ланцюговий механізм даної реакції може бути зображений так
Cl2 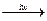 2Cl·, (1)
2Cl·, (1) 
Cl· + H2  HCl + H·, (2)
HCl + H·, (2)
H· + Cl2  HCl + Cl· , (3)
HCl + Cl· , (3)
H· + Cl·  HCl. (4)
HCl. (4)
У ланцюговому процесі розрізняють такі основні стадії:
1 Зародження ланцюга – реакції, у результаті яких із валентнонасичених молекул утворюються радикали (1).
2 Продовження ланцюга – реакції, що проходять з участю радикалів, у результаті яких вихідна речовина перетворюється у продукт реакції ( 2 і 3).
3 Обрив ланцюга – реакції, що приводять до зникнення радикалів (4).
У розглянутій реакції кількість радикалів не збільшується. Такі реакції називаються простими (нерозгалуженими)ланцюговими реакціями. До них також належать реакції:
Н2 + Br2  2HBr,
2HBr,
CO + Cl2  COCl2
COCl2
та інші. Кінетичні рівняння таких реакцій досить складні (див. розділ 9.2), що пояснюється їх складним механізмом.
Крім поданих можуть проходити реакції, за якими кількість радикалів збільшується. Такі реакції називаються розгалуженимиланцюговими реакціями(рис. 10.4).
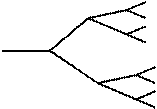
Рисунок 10.4 – Схема розгалуженої ланцюгової реакції
Прикладом такої реакції є реакція 2Н2 + О2  2H2O. Не розглядаючи повної схеми процесу, наведемо лише окремі елементарні стадії:
2H2O. Не розглядаючи повної схеми процесу, наведемо лише окремі елементарні стадії:
Н2 + О2  2OH· – зародження ланцюга;
2OH· – зародження ланцюга;
OH· + H2  H2O + H· – продовження ланцюга;
H2O + H· – продовження ланцюга;
 H· + O2
H· + O2  OH· + O·
OH· + O·
O· + H2  OH· + H· – розгалуження ланцюга;
OH· + H· – розгалуження ланцюга;
OH· + H·  H2O – обрив ланцюга.
H2O – обрив ланцюга.
До розгалужених ланцюгових реакцій належать, наприклад, реакції ядерного розпаду під дією нейтронів. Зрозуміло, що швидкість таких реакцій за деяких умов може швидко зростати, що приведе до вибуху. Вибухом називається процес швидкого виділення енергії, пов¢язаний з раптовим змінюванням стану речовини, у результаті чого у середовищі утворюється ударна, або вибухова хвиля. При ядерному вибуху відбувається миттєвий перехід внутрішньоядерної енергії атомних ядер у кінетичну енергію їх уламків. Розрізняють тепловий та ланцюговий вибухи.
Тепловий вибухвиникає за звичайної (не ланцюгової) реакції, коли виділення теплоти стає більшим від тепловіддачі.
Ланцюговий вибух,або запалення, спостерігається при проходженні ланцюгових реакцій з розгалуженими ланцюгами.
Найбільш наочною та доступною теорією ланцюгових реакцій є імовірна теорія. Відкидаючи проміжні викладки (їх можна знайти у спеціальній літературі), наведемо лише підсумкове рівняння, що описує залежність швидкості ланцюгової реакції W від часу t:
 . (10.17)
. (10.17)
Тут n0 – кількість активних частинок, що виникають в одиниці об’єму за одиницю часу під впливом зовнішньої дії; b = 1/n- імовірність обриву ланцюга; n - середня кількість кілець ланцюгу (середня кількість реакцій, які викликаються однією активною частинкою); t - час, протягом якого проходить одне кільце ланцюгової реакції; d - вірогідність розгалуження ланцюга.
Проаналізуємо записане рівняння. Припустимо відсутність розгалуження, тобто d = 0.
Тоді
 (10.18)
(10.18)

Рисунок 10.5 – Залежність швидкості ланцюгової реакції від часу: 1 – відсутність розгалуження; 2 - d<b; 3 - d>b
Як показано на рис. 10.5 (1), швидкість реакції з початку реакції збільшується досягає межі, що дорівнює nn0 = n0/b.
При 0 < d < b швидкість реакції також досягає постійного значення, але більшого, ніж у першому випадку:
n0 / (b-d) (рис. 10.5 (2)).
Зовсім інша картина буде спостерігатися, якщо імовірність розгалуження буде більша за імовірність обриву, тобто d>b.
Тоді W = 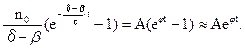 (10.19)
(10.19)
Тут А і j - позитивні постійні. Наявність у цій формулі позитивної степеневої функції часу свідчить про можливість безмежного прискорення реакції, тобто розвитку ланцюгового вибуху ( рис. 11.5 (3)).
Читайте також:
- I. Теорія граничної продуктивності і попит на ресурси
- II. Ріст репродуктивних бруньок
- IV. Запасні речовини
- V. За участю каталізатора
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Автоматичний розрахунок суми проведення.
- Агрегатні стани речовини
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аеродинамічний розрахунок
- Аеродинамічний розрахунок ротора вітроустановки
- Азот, фосфор, біогенні елементи та їх сполуки, органічні речовини
| <== попередня сторінка | | | наступна сторінка ==> |
| | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |