
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Добування фенолу
Фенол
Феноли
Феноли
Ввв
Використання Вввввв
Багатоатомні спирти
· Двохатомні спирти – гліколі: СН2 – ОН
Загальна формула СnH2n (ОН)2׀
СН2 – ОНетиленгліколь
· Трьохатомні спирти – гліцерини: СН2 – ОН
Загальна формула СnH2n–1 (ОН)3׀
СН – ОНгліцерин
׀
СН2 – ОН
·  Шестиатомні спирти:СН2 – ОН
Шестиатомні спирти:СН2 – ОН
 СН – ОН
СН – ОН
 СН – ОН сорбіт
СН – ОН сорбіт
 СН – ОН
СН – ОН
 СН – ОН
СН – ОН
СН2 – ОН
Сиропоподібні рідини без кольору та запаху, солодкуваті на смак, розчинні у воді.
Етиленгліколь
Хімічні властивості:
1 – взаємодія з активними металами:
СН2 – ОН CH2 – ONa
׀ + 2Na → ׀ + H2↑
СН2 – ОН CH2 – ONa
2 – нітрування:
СН2 – ОН CH2 – ONO2
׀ + 2HNO3 → ׀ + 2H2O
СН2 – ОН CH2 – ONO2
3 – взаємодія з галогеноводнями:
СН2 – ОН CH2 – Cl

 + HCl → + H2O
+ HCl → + H2O
СН2 – ОН CH2 – OH
4 – якісна реакція:
 СН2 – ОН CH2 – O
СН2 – ОН CH2 – O
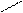 ׀ + Cu(OH)2 → ׀ Cu + 2H2O
׀ + Cu(OH)2 → ׀ Cu + 2H2O
СН2 – ОН CH2 – O
синій колір
Добування – окислення етилену (реакція Вагнера):

 СН2 = СН2 + [O] + НОН → СН2 – СН2
СН2 = СН2 + [O] + НОН → СН2 – СН2
ОН OH
Гліцерин
Хімічні властивості:
1 – взаємодія з активними металами:

 СН2 – ОН CH2 – ONa
СН2 – ОН CH2 – ONa


 2 CH – OH + 6Na → 2 CH – ONa + 3H2↑
2 CH – OH + 6Na → 2 CH – ONa + 3H2↑
СН2 – ОН CH2 – ONa
2 – нітрування:

 СН2 – ОН CH2 – ONO2
СН2 – ОН CH2 – ONO2

 CH – OH + 3HNO3 → CH – ONO2 + 3H2O
CH – OH + 3HNO3 → CH – ONO2 + 3H2O
СН2 – ОН CH2 – ONO2
3 – взаємодія з галогеноводнями:

 СН2 – ОН CH2 – Cl
СН2 – ОН CH2 – Cl

 CH – OH + HCl → CH – OH + H2O
CH – OH + HCl → CH – OH + H2O
СН2 – ОН CH2 – OH
4 – якісна реакція:


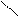 СН2 – ОН CH2 – O
СН2 – ОН CH2 – O


 CH – OH + Cu(OH)2 → CH – O Cu + 2H2O
CH – OH + Cu(OH)2 → CH – O Cu + 2H2O
СН2 – ОН CH2 – OH
синій колір

· 






 це органічні сполуки, у яких група ОН безпосередньо зв’язана з бензольним кільцем: ОН ОН ОН
це органічні сполуки, у яких група ОН безпосередньо зв’язана з бензольним кільцем: ОН ОН ОН









 ОН ОН ОН СН3
ОН ОН ОН СН3
 |  |  |  |  |  |







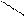


ОН СН3
фенол пірокатехін ОН о–крезол м–крезол СН3
резорцин п–крезол
Фізичні вла
· 

 це органічні сполуки, у яких група ОН безпосередньо зв’язана з бензольним кільцем: ОН ОН ОН
це органічні сполуки, у яких група ОН безпосередньо зв’язана з бензольним кільцем: ОН ОН ОН









 ОН ОН ОН СН3
ОН ОН ОН СН3
 |  |  |  |  |

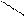


ОН СН3
фенол пірокатехін ОН о–крезол м–крезол СН3
резорцин п–крезол
 ОН СН3 ОН
ОН СН3 ОН






 ׀ СН ׀ ОН
׀ СН ׀ ОН
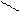

 СН3
СН3
 α – нафтол β – нафтол
α – нафтол β – нафтол
Н3С тимол
Фізичні властивості:
Тверда речовина без кольору з характерним запахом, малорозчинний, на повітрі окислюється й набуває рожевого кольору. При попаданні на шкіру викликає опіки. Розчин фенолу у воді – карболова кислота.
Хімічні властивості
І . Реакції гідроксогрупи ОН
1 – взаємодія з активними металами:
ОН ONa
 |  |

 2 + 2Na → 2 + H2
2 + 2Na → 2 + H2
2 – взаємодія з лугами:
 ОН ONa
ОН ONa
 | |||
 | |||


 + NaОН → + H2О
+ NaОН → + H2О
3 – розклад фенолятів кислотами:

 ONa ОН
ONa ОН
 |  |

 +HCl → ↓ + NaCl
+HCl → ↓ + NaCl
4 – якісна реакція:
C6H5OH + FeCl3 → C6H5OFeCl2 + HCl
фіолетовий колір
ІІ. Реакції бензольного ядра – гідроксогрупа є орієнтантом І роду
(орто – , пара – орієнтантом)
1 – нітрування:
 ОН ОН
ОН ОН




 O2N NO2
O2N NO2

 + 3HNO3 → + 3H2O
+ 3HNO3 → + 3H2O
 |
NO2 2,4,6 – тринітрофенол
(пікринова кислота)
2 – знебарвлення бромної води:

 ОН ОН
ОН ОН



 Br Br
Br Br

 + 3Br2 → ↓ + 3HBr
+ 3Br2 → ↓ + 3HBr
 |
Br
білий осад
Cl OH
+ Cl2׀+ NaOH׀







 1 – через хлорбензол:
1 – через хлорбензол:
– HCl – NaCl

 2 – через бензолсульфокислоту:SO3H OH
2 – через бензолсульфокислоту:SO3H OH


 + H2SO4 + NaOH
+ H2SO4 + NaOH





– H2O – NaHSO3
3 – промисловий спосіб (кумольний):

 CH3 – CH – CH3 OH
CH3 – CH – CH3 OH





 + CH2 = CH – CH3 + [O]+ CH3 – C – CH3
+ CH2 = CH – CH3 + [O]+ CH3 – C – CH3

 ׀׀
׀׀
O
кумол фенол ацетон
Розпізнавання спиртів та фенолу
| речовина реактив | одноатомні спирти | багатоатомні спирти | фенол |
| CuO прожарений мідний дріт (чорний) | червоний колір дроту | – | – |
| свіжевиготовлений Cu(OH)2 (CuSO4 + NaOH) | – | синій розчин | – |
| розчин FeCl3 | – | – | фіолетовий розчин |
| бромна вода Br2/ H2O | – | – | знебарвлення розчину, білий осад |
Використання спиртів у медицині
· Етиловий спирт С2Н5ОН: –антисептичний засіб;
– засіб для розтирання та зігріваючих компресів;
– розчинник для виготовлення настоянок,
екстрактів, спиртових розчинів лікарських
препаратів.
· Гліцерин –основа для виготовлення мазей.
· Нітрогліцерин –спазмолітичний засіб при стенокардії.
· Сорбіт –замінник цукру для хворих на цукровий діабет.
Використання фенолів у медицині
· Фенол, крезол, тимол, резорцин –антисептичні засоби, дія яких основана на
здатності зсідати білки. Мають
бактерицидну дію, тобто вбивають
мікроорганізми або створюють шкідливі
умови для їх життєдіяльності.
· Адреналін
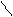 НО – звуження судин шкіри, слизових оболонок
НО – звуження судин шкіри, слизових оболонок
 при алергічних набряках;
при алергічних набряках;
НО – – СН – СН2 – NH – CH3 – розширення бронхів при бронхіальній
– – СН – СН2 – NH – CH3 – розширення бронхів при бронхіальній
׀астмі;
ОН – пряме введення у серце при зупинці серця.
· Норадреналін –для підвищення артеріального тиску при хірургічних
операціях.
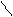 НО
НО

НО – – СН – СН2 – NH2
– – СН – СН2 – NH2
׀
ОН
· Ізадрин –розширення бронхів при бронхіальній астмі.
НО


НО – – СН – СН2 – NH – СН – СН3
– – СН – СН2 – NH – СН – СН3
׀׀
ОН СН3
· Мезатон– для підвищення артеріального тиску
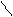 НО при операціях (порівняно з
НО при операціях (порівняно з
 норадреналіном діє не так різко, але
норадреналіном діє не так різко, але
 – СН – СН2 – NH – CH3 довше);
– СН – СН2 – NH – CH3 довше);
׀–для звуження судин та зменшення
ОН запальних явищ при нежиті.
· Ефедрин –бронхіальна астма;
– алергічні набряки;
 –риніт.
–риніт.
 – СН – СН2 – NH – CH3
– СН – СН2 – NH – CH3
׀
ОН
Етери ( прості ефіри )
· це органічні сполуки, в молекулах яких два вуглеводневих радикали зв’язані атомом Оксигену:R – O – R
Якщо радикали однакові, то етер називають симетричним; якщо різні –
несиметричним (змішаним):
СН3 – О – СН3 диметиловий етер
С2Н5 – О – С2Н5 діетиловий етер
СН3 – О – С2Н5 етилметиловий етер
Загальна формула СnH2n+2O
Ізомерія:– за вуглецевим скелетом;
– міжкласова ізомерія (зі спиртами).
Фізичні властивості:
Нижчі етери – гази або легко леткі рідини з характерним запахом, легко займаються, у воді нерозчинні, але самі є хорошими органічними розчинниками. У суміші з повітрям вибуховонебезпечні.
Хімічні властивості:
Хімічна активність етерів невелика, зв’язки С – О міцні й розриваються важко.
1 –розкладання етерів під дією йодоводню при нагріванні – йод з’єднується з
меншим радикалом:
СН3 – О – С2Н5 + НІ → СН3І + С2Н5ОН
HCl та HBr не розкладають етери.
2 – розкладання етерів під дією концентрованої сульфатної кислоти:
СН3 – О – С2Н5 + НО – SO3H → СН3 – O – SO3H + С2Н5ОН
складний ефір –
метилсульфатна кислота
Добування:
1 –міжмолекулярна дегідратація спиртів
 CH3OH H2SO4
CH3OH H2SO4

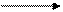 СН3 – О – СН3 + H2O
СН3 – О – СН3 + H2O
CH3OH до 140°С
 |
CH3OH H2SO4

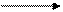 СН3 – О – С2Н5 + H2O
СН3 – О – С2Н5 + H2O
C2H5OH до 140°С
2 – з алкоголяту та галагенопохідного
C2H5 – ONa + I – CH3→ С2Н5 – О – СН3 + NaI
Використання у медицині:
Діетиловий етер (сірчаний ефір) –інгаляційний наркоз.
Карбонільні сполуки
· це органічні сполуки, що містять функціональну групу – карбонільну:

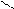 C = O
C = O
  O O
 R – C R – C
|
Альдегідимістять карбонільну групу, зв'язану з одним радикалом і одним атомом Н. У них функціональна група завжди кінцева:
H
Кетонимістять карбонільну групу, зв'язану з двома радикалами. Функціональна група знаходиться в середині вуглецевого скелету:
R – C – R
׀׀
O
Альдегіди та кетони – ізомери між собою ( міжкласова ізомерія). Їх загальна формула: CnH2nO
 O метаналь O метаналь
  Н – C мурашиний альдегід
Н формальдегід Н – C мурашиний альдегід
Н формальдегід
|
Гомологічні ряди:
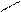
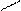 O етаналь
O етаналь
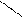 СН3 – C оцтовий альдегід
СН3 – C оцтовий альдегід
  O O
 С2Н5 – C пропаналь СН3 – С – СН3 пропанон
Н ׀׀ ацетон С2Н5 – C пропаналь СН3 – С – СН3 пропанон
Н ׀׀ ацетон
  O О O О
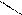 С3Н7 – C бутаналь СН3 – С – СН2 – СН3 бутанон С3Н7 – C бутаналь СН3 – С – СН2 – СН3 бутанон
|
Н ацетальдегід
Н ׀׀
О
 O O
  С4Н9 – C пентаналь СН3 – С – СН2 – СН2 – СН3 пентанон – 2 С4Н9 – C пентаналь СН3 – С – СН2 – СН2 – СН3 пентанон – 2
|
Н ׀׀
О
СН3 – СН2 – С – СН2 – СН3 пентанон – 3
׀׀
суфікс –альО
суфікс –он
Ізомерія:– за вуглецевим скелетом;
– міжкласова ізомерія.
Електронна будова:
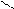
 C = O
C = O
· Подібність до алкенів:– тип гібридизації sp2
– валентний кут 120°
– форма молекули площинна
· Відмінність від алкенів:у молекулахалкенів подвійний зв’язок С = С неполярний, а в карбонільних сполуках С = О полярний:
δ+ δ–

 С => О
С => О
Чим більш полярний зв’язок, тим він більш реакційно здатний.
· Порівняльна характеристика альдегідів та кетонів


 δ+О δ–δ+О δ– δ+
δ+О δ–δ+О δ– δ+


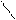

 Н –СR → C R → C ← R
Н –СR → C R → C ← R
Н H О
Альдегіди більш активні, ніж кетони.
Серед альдегідів найбільш активний – формальдегід.
Фізичні властивості
Альдегіди та кетони, за винятком формальдегіду, рідкі або тверді речовини, мають характерний запах. Нижчі представники добре розчинні у воді.
Хімічні властивості альдегідів
Характерні 3 види реакцій:
1) реакції окислення Н
2) реакції карбонільної групи
3) реакції радикалу.
1. Реакції окислення:
· реакція „срібного дзеркала":


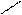
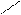 О О
О О

 СН3 – С + Ag2O → СН3 – С + 2Ag↓
СН3 – С + Ag2O → СН3 – С + 2Ag↓
НОН
· окислення Сu (ОН)2:

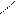
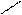
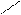 О О
О О

 СН3 – С + 2Cu(OH)2 → СН3 – С + Cu2O↓ + 2H2O
СН3 – С + 2Cu(OH)2 → СН3 – С + Cu2O↓ + 2H2O
НОН червоний
2. Реакції карбонільної групи:
а – приєднання:
· приєднання водню (гідрогенізація, відновлення):
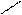
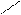 О
О
 СН3 – С + Н2 → СН3 – СН2ОН
СН3 – С + Н2 → СН3 – СН2ОН
Н
Утворюється первинний спирт.
· приєднання аміаку:
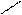
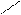 О + H2
О + H2


 СН3 – С + NН3 → СН3 – СНОН СН3 – СН СН3 – СН2
СН3 – С + NН3 → СН3 – СНОН СН3 – СН СН3 – СН2
Н ׀ – H2O ׀׀ ׀
NH2 NH NH2
Реакція використовується для добування амінів.
· приєднання синильної кислоти:
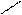
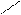 О + H2O + HCl
О + H2O + HCl

 СН3 – С + НСN → СН3 – СНОН CH3 – CH – COOH
СН3 – С + НСN → СН3 – СНОН CH3 – CH – COOH
Н ׀– NH4Cl ׀
СN OH
Реакція використовується для добування гідроксикислот.
· приєднання натрій гідрогенсульфіту:
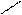
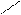 О
О
 СН3 – С + H – SO3Na → СН3 – СНОН ↓
СН3 – С + H – SO3Na → СН3 – СНОН ↓
Н ׀
SO3Na
Реакція використовується для виділення альдегідів з суміші. Гідрогенсульфітні сполуки альдегідів легко розкладаються кислотами та лугами з виділенням вихідних альдегідів.
· приєднання спиртів:
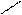
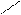 О
О
 СН3 – С + С2Н5ОН → СН3 – СНОН
СН3 – С + С2Н5ОН → СН3 – СНОН
Н ׀
ОС2Н5 напівацеталь
ОС2Н5
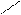
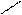 О ׀
О ׀
 СН3 – С + 2С2Н5ОН → СН3 – СН
СН3 – С + 2С2Н5ОН → СН3 – СН
Н ׀
ОС2Н5 ацеталь
Ця реакція лежить в основі утворення циклічної форми вуглеводів.
· альдольна конденсація:
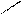
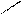
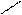
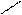
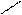
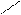 О О О
О О О
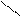

 СН3 – С + Н – СН2 – С → СН3 – СН – СН2 – С
СН3 – С + Н – СН2 – С → СН3 – СН – СН2 – С
Н Н ׀ Н
ОН альдоль
б – заміщення Оксигену:
· заміщення галогенами:

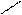
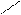 О Сl
О Сl

 СН3 – С + РCl5 → СH3 – С – Сl + РОCl3
СН3 – С + РCl5 → СH3 – С – Сl + РОCl3
Н Н
· реакція з гідроксиламіном:
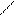
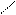
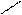
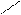 О N – OH
О N – OH

 СН3 – С + Н2N – OH → СH3 – С + H2O
СН3 – С + Н2N – OH → СH3 – С + H2O
Н Н
альдоксим
· реакція з фенілгідразином:
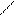
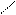
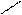
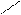 О N – NH – C6H5
О N – NH – C6H5

 СН3 – С + Н2N – NH – C6H5 → СH3 – С + H2O
СН3 – С + Н2N – NH – C6H5 → СH3 – С + H2O
Н Н
фенілгідразон
Ці реакції використовують для виділення альдегідів з суміші.
3. Реакції радикалу:


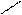
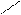 О О
О О

 СН3 – С + Cl2 → СH2 – С + HCl
СН3 – С + Cl2 → СH2 – С + HCl
Н ׀Н
Cl
Добування альдегідів
1 – окислення первинних спиртів:
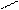 O
O

 CH3 – СН2OH + CuO → СH3 – C + Cu + H2O
CH3 – СН2OH + CuO → СH3 – C + Cu + H2O
H
2 – відновлення кислот:

 О О
О О

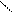
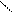
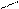 СН3 – С + Н2 → СН3 – С + H2O
СН3 – С + Н2 → СН3 – С + H2O
ОН Н
3 – добування ацетальдегіду (реакція Кучерова):

 О
О
 СН ≡ СН + НОН → СН3 – С
СН ≡ СН + НОН → СН3 – С
Н
Використання альдегідів у медицині


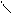 О
О
· Формальдегід Н – С
Н
40% розчин формальдегіду називається формалін.Формальдегід має здатність звертати білки, тому формалін застосовують для дезинфекції рук, інструментів та для консервації анатомічних препаратів.
З формальдегіду добувають:
· гексаметилентетрамін (уротропін):
 6СН2О + 4NH3 → (СН2)6N4 + 6Н2О
6СН2О + 4NH3 → (СН2)6N4 + 6Н2О
Уротропін легко гідролізується з утворенням формальдегіду:
(CH2)6N4 + 6Н2О → 6СН2О + 4NH3
Тому уротропін використовують внутрішньо як антисептик.

 О
О
·  Ацетальдегід СН3 – С
Ацетальдегід СН3 – С
Н
У присутності кислоти полімеризується у паральдегід:



 О О
О О
 3СН3 – С → Н3С – СН СН – СН3
3СН3 – С → Н3С – СН СН – СН3
Н ׀ ׀

 О О
О О
СН
׀
Паральдегід – снодійний засіб. СН3
· Хлоралгідрат –снодійний засіб:


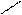
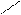 О О
О О

 СН3 – С + 3Cl2 → СCl3 – С + HOH → СCl3 – СH – OH
СН3 – С + 3Cl2 → СCl3 – С + HOH → СCl3 – СH – OH
Н – HCl Н ׀
OH
· Бензальдегід –міститься в мигдалі, кісточках персиків та абрикосів. Використовується в парфумерії, харчовій промисловості. Є основою для добування ваніліну.


 О
О
 – С
– С
 Н
Н
· Ванілін –є основою для синтезу фтивазиду – протитуберкульозного препарату.

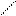
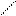 О
О

 НО – – С
НО – – С
 Н
Н
СН3О
Хімічні властивості кетонів
1. Реакції окисленняслабкими окисниками (Ag2O, Си(ОН)2) не характерні. Під дією сильних окисників відбувається розрив зв’язків С – С і утворюється суміш карбонових кислот з меншим числом атомів С.
2. Реакції карбонільної групи:
а – приєднання:
· приєднання водню (гідрогенізація, відновлення):
 Н3С
Н3С
С = О + Н2 → СН3 – СН – СН3
 Н3С׀
Н3С׀
ОН
Утворюється вторинний спирт.
· приєднання аміаку:
NH2 NH NH2
 Н3С ׀ ׀׀ + H2 ׀
Н3С ׀ ׀׀ + H2 ׀

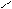 С = О + NН3 → СН3 – С – СН3 СН3 – С – СН3 → СН3 – СH – СН3
С = О + NН3 → СН3 – С – СН3 СН3 – С – СН3 → СН3 – СH – СН3
Н3С׀ – H2O
ОН
Реакція використовується для добування амінів.
· приєднання синильної кислоти:
CN COOH
 Н3С ׀ + H2O + HCl ׀
Н3С ׀ + H2O + HCl ׀
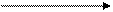 С = О + HCN → СН3 – С – СН3 СН3 – С – СН3
С = О + HCN → СН3 – С – СН3 СН3 – С – СН3
 Н3С׀ – NH4Cl ׀
Н3С׀ – NH4Cl ׀
ОН OH
Реакція використовується для добування гідроксикислот.
· приєднання натрій гідрогенсульфіту:
SO3Na
 Н3С ׀
Н3С ׀
 C = O + H – SO3Na → CH3 – C – CH3 ↓
C = O + H – SO3Na → CH3 – C – CH3 ↓
H3C ׀
OH
· приєднання спиртів:
OС2Н5
 Н3С ׀
Н3С ׀
 C = O + С2Н5ОН → CH3 – C – CH3 напівкеталь
C = O + С2Н5ОН → CH3 – C – CH3 напівкеталь
H3C ׀
OH
OС2Н5
 Н3С ׀
Н3С ׀
 C = O + 2С2Н5ОН → CH3 – C – CH3 кеталь
C = O + 2С2Н5ОН → CH3 – C – CH3 кеталь
H3C ׀
OС2Н5
б – заміщення Оксигену:
· заміщення галогенами:
Cl
 Н3С ׀
Н3С ׀
 С = О + РCl5 → СН3 – С – СН3 + РОCl3
С = О + РCl5 → СН3 – С – СН3 + РОCl3
Н3С׀
Cl
· реакція з гідроксиламіном:

 Н3С H3C
Н3С H3C
 С = О + Н2N – OH → С = N – OH + H2О
С = О + Н2N – OH → С = N – OH + H2О
Н3СH3C
кетоксим
· реакція з фенілгідразином:
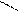
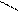 H3C Н3С
H3C Н3С
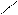
 С = О + Н2N – NH – C6H5 → С = N – NH – C6H5 + H2О
С = О + Н2N – NH – C6H5 → С = N – NH – C6H5 + H2О
Н3СH3C
фенілгідразон
3. Реакції радикалу:

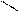 Н3С ClH2C
Н3С ClH2C
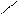
 С = О + Cl2 → С = О + HCl
С = О + Cl2 → С = О + HCl
Н3СH3C
Хлор – та бромацетон подразнюють слизові оболонки, викликають задуху та сльозотечу. Їх використовували під час війни як сльозоточиві засоби.
Добування кетонів
· окислення вторинних спиртів:
Н3С 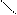
СН3 – СН – СН3 + CuO → С = О + Cu + Н2О
 ׀ Н3С
׀ Н3С
ОН
· гідроліз дигалогенопохідних:
Cl ОН
 ׀ + NaOH׀ Н3С
׀ + NaOH׀ Н3С
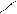
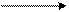 СН3 – С – СН3 СН3 – С – СН3 → С = О + H2O
СН3 – С – СН3 СН3 – С – СН3 → С = О + H2O
׀ – NaCl׀H3C
Cl OH
· перегонка солей кальцію:
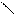 t°H3C
t°H3C
 (СН3СОО)2Са → C = O + CaCO3
(СН3СОО)2Са → C = O + CaCO3
H3C
Карбонові кислоти
· це органічні сполуки, що містять одну або декілька груп СООН.
Функціональна група СООН – карбоксильна:
  O O
 – СООН або – C – СООН або – C
|
Класифікація кислот: ОН
· за кількістю груп СООН:
– одноосновні кислоти (монокарбонові):
НСООН СН3СООН
– двохосновні кислоти (дикарбонові):
СООН СООН
׀ ׀
СООН СН2
щавлева ׀
СООН малонова
– трьохосновні кислоти (трикарбонові):
СН2 – СООН
׀
НО – С – СООН
׀
СН2 – СООН лимонна
· за будовою вуглеводневого радикалу:
– насичені кислоти СН3 – СН2 – СООН
– ненасичені кислоти СН2 = СН – СООН

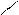 – ароматичні кислоти СООН
– ароматичні кислоти СООН

Монокарбонові насичені кислоти
Загальна формула СnH2n + 1 СООН
Гомологічний ряд:
| Формула кислоти | Тривіальна назва | Систематична назва | Назва солі |
| НСООН | мурашина | метанова | форміат |
| СН3СООН | оцтова | етанова | ацетат |
| С2Н5СООН | пропіонова | пропанова | пропіонат |
| С3Н7СООН | масляна | бутанова | бутират |
| С4Н9СООН | валер’янова | пентанова | пентаноат |
| С5Н11СООН | капронова | гексанова | гексаноат |
Хімічні властивості оцтової кислоти
І. Загальні властивості кислот:
СН3СООН + NaOH → CH3COONa + H2O
2СН3СООН + 2Na → 2CH3COONa + H2↑
2СН3СООН + Na2O → 2CH3COONa + H2O
2СН3СООН + Na2CO3 → 2CH3COONa + H2O + CO2
ІІ. Властивості карбонових кислот:
1 – утворення амідів



 O t° O
O t° O

 СН3 – С + NH3 → СН3 – С + H2O
СН3 – С + NH3 → СН3 – С + H2O
OH NH2
2 – утворення галогенангідридів



 O O
O O

 СН3 – С + PCl5 → СН3 – С + POCl3 + HCl
СН3 – С + PCl5 → СН3 – С + POCl3 + HCl
OH Cl
3 – утворення естерів:



 O O
O O

 СН3 – С + C2Н5ОН → СН3 – С + H2O
СН3 – С + C2Н5ОН → СН3 – С + H2O
OH ОC2Н5
4 – утворення ангідридів



 O Р2О5 O
O Р2О5 O

 2СН3 – С → СН3 – С + H2O
2СН3 – С → СН3 – С + H2O
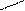 OH О
OH О
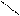
 СН3 – С
СН3 – С
О
ІІІ. Особливості кислоти:
СН3СООН + Cl2 →СН2СООН + HCl
׀
Cl
Якісна реакція: 3СН3СООН + FeCl3 → (СН3СОО)3Fe + 3HCl
бурий осад
ІV. Використання у медицині:
· 3%, 6%, 9% розчини – оцет,використовується для обтирання та компресів.
· Ацетат калію СН3СООК –діуретичний засіб при набряках серцевого походження.
Хімічні властивості мурашиної кислоти
І. Загальні властивості кислот:
НСООН + NaOH → HCOONa + H2O
2НСООН + 2Na → 2HCOONa + H2↑
2НСООН + Na2O → 2HCOONa + H2O
2НСООН + Na2CO3 → 2HCOONa + H2O + CO2
ІІ. Властивості карбонових кислот:
1 – утворення амідів



 O t° O
O t° O

 Н – С + NH3 → Н – С + H2O
Н – С + NH3 → Н – С + H2O
OH NH2
2 – утворення галогенангідридів



 O O
O O

 Н – С + PCl5 → Н – С + POCl3 + HCl
Н – С + PCl5 → Н – С + POCl3 + HCl
OH Cl
3 – утворення естерів:



 O O
O O

 Н – С + C2Н5ОН → Н – С + H2O
Н – С + C2Н5ОН → Н – С + H2O
OH ОC2Н5
Читайте також: Переглядів: 4036 Не знайшли потрібну інформацію? Скористайтесь пошуком google:
<== попередня сторінка
|
наступна сторінка ==>
R H R H | Малонова кислота Янтарна кислота
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |