
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Вода. Методи пом’якшення води
Природна вода завжди містить розчинені в ній солі, які обумовлюють твердість води. Розрізняють тимчасову твердість води, яка обумовлена гідрокарбонатами кальцію і магнію (Са(НСО3)2, Mg(НСО3)2. Називається вона так тому, що при кип’ятінні її можна усунути, внаслідок розкладу гідрокарбонатів, які перетворюються в важко розчинені карбонати (СаСО3, MgСО3), які випадають в осад, утворюється накип.
Постійна твердість води обумовлюється хлоридами і сульфатами кальцію і магнію (СаCl2, CaSO4, MgCl2, MgSO4). Ця твердість води не усувається кип’ятінням і необхідно використовувати хімічні реактиви для її усунення.
Тимчасова і постійна твердість обумовлюють загальну твердість води, яка характеризується або вимірюється сумарною концентрацією іонів кальцію і магнію в міліграм-еквівалент на 1 кг води (мг-екв/кг). Міліграм-еквівалент – це кількість речовини, яка відповідає її відносній атомній масі. Так, 1 мг-екв/кг відповідає 0,02 мг Са і 0,012 мг магнію на 1 кг води. Для забезпечення довготривалої і безаварійної роботи сучасних судових паросилових установ необхідно застосовувати ряд заходів, пов’язаних із застосуванням різних хімічних реагентів. До них відносяться реагенти, які покращують якість котлових і поживних вод і регулюють внутрішньо-котлові фізико-хімічні процеси.
В зв’язку з тим, що Ca і Mg широко розповсюджені в природі, їх солі завжди містяться в природній воді. Із природних солей кальція тільки гіпс незначно розчинений в воді. Якщо вода містить карбон (IV) оксид, то карбонат кальція може переходити в розчин в вигляді гідрокарбонату кальція.
CaCO3+CO2+H2O 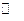 Ca(HCO3)2
Ca(HCO3)2
Природна вода, яка містить значну кількість солей кальцію і магнію називається твердою водою навпаки м’яка вода містить мало солей кальцію і магнію, або зовсім їх не містить.
Розрізняють карбонатну (або тимчасову) твердість, яка називається солями гідрокарбонатами кальцію і магнію Ca(HCO3)2, Mg(HCO3)2 і не карбонатну (або постійну) твердість, яка визивається солями хлоридами і сульфатами кальцію і магнію (CaCl2. MgCl2, CaSO4, MgSO4). Тимчасова і постійна твердість обумовлюють загальну твердість води. Карбонатна або тимчасова твердість називається так тому, що усувається при кип’ятінні.
Ca(HCO3)2  CaCO3
CaCO3  +СО2+Н2О;
+СО2+Н2О;
Mg(HCO3)2  MgCO3
MgCO3  +СО2+Н2О
+СО2+Н2О
Випадає осад CaCO3 і MgCO3
Хлориди і сульфати кальцію і магнія не можна осаджати простим кип’ятінням. Для їх осадження застосовують хімічні або фізико-хімічні методи.
Підвищення концентрації розчину солей в котловій воді приводить до утворення накипу, в результаті чого гірше проводиться тепло, відбувається перегрів котла, що може призвести до вибуху. Під дією води, пара і пароводяної суміші металічна поверхня нагріву котла підлягає дії міжкристалітної корозії, такий метал зберігає форму і розміри, але при ударі руйнується. Своєчасно виявити цей вид корозії можна тільки за допомогою ультразвукових і магнітноскопічних дефектоскопів.
Вода широко використовується в техніці: в хімічних виробництвах як розчинник і реагент, для промиття різних речовин, для парових котлів. З розвитком техніки використання води значно росте і проблеми води для технічних потреб і життя людини в багатьох країнах світа залишається не вирішеною.
Значний вплив на властивості води надають розчинені в ній домішки. Так, вода морів і океанів непридатна для технічних потреб, для палива грунту, так як в ній міститься велика кількість солей. Артезіанська вода може містить різні домішки, але в значно меншій кількості. Ці домішки необхідні для життя людини, тварин і рослин, але не завжди придатна для застосування в техніці. Так, наявність в воді солей марганцю, навіть в невеликих дозах, робить її непридатною в виробництві волокна, так як марганець окислюється киснем повітря і випадає в вигляді диоксиду марганца, фарбуючи волокна в бурий колір. Для парових котлів особливо небезпечними є солі кальція і магнія, а також кремнієва кислота. Ці солі при високій температурі утворюють осад на стінках котла. Накип погано проводить тепло, тому відбувається перегрів котла, що може призвести до вибуху. Ці ж солі осаджуються на внутрішніх стінках труб в системах водяного охолодження, зменшують теплообмін і виводять систему з ладу. Твердість природної води залежить від джерела і від пори року. Під час весняних паводків твердість води поверхневих басейнів зменшується , а в зимовий період збільшується. Кількісно твердість характеризується сумарною концентрацією йонів кальцію і магнію, виражених в міліграм –еквівалентних на 1 кг. води
(мг-екв/кг). Прийнятий за одиницю твердості 1 мг-екв/кг відповідає вмісту 0,02 мг. кальція і 0,012 мг. магнія в 1 кг. води.
Вода з твердістю менше 4 мг-екв/л характеризується як м’яка, від 4 до 8 мг-екв/л як вода середньої твердості, а вище 12 мг екв/л – як тверда вода. Морська вода характеризується загальною твердістю 65 мг екв/л.
Твердість води можна усунути: фізичними, хімічними і фізико-хімічни ми методами. Фізичні методи – це кипятіння, дистиляція, перегонка води. При кипятінні усувається тимчасова твердість, так як гідрокарбонати кальція і магнія випадають в осад в вигляді нерозчинних солей карбонатів
Ca(HCO3)2  CaCO3+CO2+H2O
CaCO3+CO2+H2O
Mg (HCO3)2  MgCO3+CO2+H2O
MgCO3+CO2+H2O
Постійну твердість води можна усунути хімічними або фізико-хімічними методами.
До хімічних методів відноситься:
- вапняковий метод:
MgCl2+Ca(OH)2  Mg(OH)2+CaCl2
Mg(OH)2+CaCl2
- содовий метод:
CaSO4+Na2CO3  CaCO3+Na2SO4
CaCO3+Na2SO4
Для усунення тимчасової твердості методом осадження використовують вапняковий, натронний і содовий методи.
Ca(HCO3)2+Ca(OH)2=2CaCO3  +2H2O
+2H2O
Mg(HCO3)2+2Ca(OH)2=2CaCO3  +Mg(OH)2+2H2O – вапняковий метод;
+Mg(OH)2+2H2O – вапняковий метод;
Ca(HCO3)2+2NaOH=2CaCO3  +Na2CO3 2H2O
+Na2CO3 2H2O
Mg(HCO3)2+4NaOH=Mg(OH)2+2Na2CO3+2H2O– натронний метод
Ca(HCO3)2+ Na2CO3=CaCO3  +2NaHCO3
+2NaHCO3
Mg(HCO3)2+Na2CO3=MgCO3+2NaHCO3содовий метод
Для усунення постійної твердості використовують содовий і фосфатний методи.
СaSO4+Na2CO3=CaCO3+Na2SO4
MgSO4+Na2CO3=MgCO3+Na2SO4 – содовий метод;
3СaSO4+2Na3PO4=Ca3(PO4)2+3Na2SO4
3MgSO4+2Na3PO4=Mg3(PO4)2+3Na2SO4
Останнім часом для обессолювання води широко застосовують іоніти. Іонітами називаються неплавкі і нерозчинні (або малорозчинні) речовини, які набухають в воді і містять в своїй структурі функціональні групи кислотного і основного характеру. В розчинах іоніти здатні обмінюватися іонами. Найчастіше іоніти являють собою тверді високомолекулярні полі кислоти і полі основи або їх солі. В залежності від характеру функціональних груп, іоніти можуть обмінюватися катіонами або аніонами. Перші називаються катіоніти, другі – аніоніти. Тому при пропусканні розчину солі через катіоніт в Н – формі виділяються водневі іони і поглинаються іони метала, а при пропусканні розчину солі через аніоніт в ОН- формі поглинаються аніони і в розчин переходять гідроксильні групи.
В разі застосування іонічної очистки води користуються також катіонітами в натрієвій формі. При пропусканні води через такі катіони кальцій і магній обмінюються на натрій і вода від них звільняється. Застосовується також послідовне пропускання води через катіоніт в Н- формі (НКt), а потім через аніоніт в ОН-формі (AnOH). При проходженні води через катіоніт в Н-формі іони кальцію і магнію обмінюються на іони гідрогену і вода стає кислою.
CaSO4+2HKt 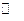 Ca(Kt)2+H2SO4
Ca(Kt)2+H2SO4
Така вода непридатна для технічних цілей, так як вона буде визивати сильну корозію труб, тому далі цю воду пропускають через аніоніт
В ОН- формі
H2SO4+2AnOH 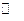 (An)2SO4+2H2O
(An)2SO4+2H2O
Після цього вода стає обессоленою, практично нейтральна вода, яку широко застосовують в техніці. При іонічній обробці води видаляються не тільки солі кальція і магнія, але й всі останні солі, що робить воду ще більш придатною для різних цілей.
Читайте також:
- I. ЗАГАЛЬНІ МЕТОДИЧНІ ВКАЗІВКИ
- II. УЧЕБНЫЕ И МЕТОДИЧЕСКИЕ ПОСОБИЯ, ПРАКТИКУМЫ
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Агрегативна стійкість, коагуляція суспензій. Методи отримання.
- Адаптовані й специфічні методи дослідження у журналістикознавстві
- Адміністративні (прямі) методи регулювання.
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
- Адміністративні методи управління
- Адміністративні, економічні й інституційні методи.
- Адміністративно-правові (організаційно-адміністративні) методи мотивації
- Адміністративно-правові методи забезпечення економічного механізму управління охороною довкілля
- Аерометоди
| <== попередня сторінка | | | наступна сторінка ==> |
| Хімічні властивості води. | | | Традиційні методи водообробки і водоконтролю парових котлів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |