
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Хімічні властивості води.
Молекули води відрізняються стійкістю до нагрівання. Але при температурі вище 1000 0 С водяний пар починає розпадатись на водень і кисень.
2Н2О 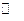 2Н2+О2
2Н2+О2
Процес розкладу речовини при нагріванні називається термічною дисоціацією. Термічна дисоціація води протікає з поглинанням тепла, а тому відповідно принципу Ле Шательє, чим вища температура, тим в більшій ступені розпадається вода. Навіть при температурі 2000 0 С ступінь термічної дисоціації води не перевищує 2 %, тобто рівновага, тобто рівновага між газоподібною водою і продуктами її дисоціації – воднем і киснем – все ще лишається зміщеним в сторону води.
Вода дуже реакційно здатна речовина. Оксиди багатьох металів і неметалів реагують з водою утворюючи основи і кислоти, деякі солі утворюють з водою кристалогідрати і найбільш активні метали взаємодіють з водою з виділенням водню.
Вода є каталізатором в багатьох реакціях. Вода взаємодіє з багатьма газами, утворюючи при цьому гідрати газів. (Хе  Н2О, Cl2
Н2О, Cl2  8H2O, C2H6
8H2O, C2H6  6Н2О), які випадають в вигляді кристалів при температурах від 0 до 240 С. Подібні сполуки виникають в результаті заповнення молекулами газа міжмолекулярних просторів, які є в структурі води, вони називаються сполуками включення або клатратами.
6Н2О), які випадають в вигляді кристалів при температурах від 0 до 240 С. Подібні сполуки виникають в результаті заповнення молекулами газа міжмолекулярних просторів, які є в структурі води, вони називаються сполуками включення або клатратами.
Клатрати –нестійкі сполуки, які можуть існувати тільки при низьких температурах. В останній час утворення і розклад клатратів газів (пропана і деяких інших) застосовують для обесолювання води. Нагнічуючи в солену воду при підвищеному тиску відповідний газ, отримують льодоподібні кристали клатратів, а солі залишаються в розчині. Подібну на сніг масу кристалів відділяють від маточкового розчину і промивають. Потім при деякому підвищенні температури чи зменшенні тиску клатрати розпадаються , утворюючи обессолену воду і вихідний газ, який знову використовується для отримання клатратів. Висока економічність цього процесу роблять його перспективним в якості промислового способу опріснення морської води.
При електролізі звичайної води, яка містить крім молекул Н2О також незначну Д2О, утвореними важким ізотопом водню дейтерієм, розкладу підлягають в основному молекули Н2О. Тому при довготривалому електролізі води залишок збагачується молекулами Д2О. З такого залишку після після багаторазового повторення електролізу в 1933 р. вперше отримано невелику кількість води, яка складалась майже зі 100% молекул Д2О і названа важкою водою. По своїм властивостям важка вода відрізняється від звичайної води
| Константи | Н2О | Д2О |
| Молекулярна маса | ||
| Температура замерзання, 0 С | 3,8 | |
| Температура кипіння, 0 С | 101,4 | |
| Густина при 25 0 С, г/см3 | 0,99 | 1,1 |
| Температура максимальної густини, 0 С | 11,6 |
Розчини – це однорідні галогенні системи, які складаються з молекул розчинника, розчиненої речовини і продуктів їх взаємодії.
По агрегатному стану розрізняють:
- рідки розчини (розчини кислот, солей, основ);
- тверді розчини (сплави);
- газоподібні розчини (повітря).
Процес розчинення твердих речовин складається з 4- х стадій:
- дифузія молекул розчинника і розчиненої речовини;
- стадія орієнтації молекул розчинника і розчиненої речовини;
- розрив кристалічної решітки;
- стадія гідратації (якщо розчинник вода);
- стадія сольватації, якщо розчинник люба інша речовина (бензин, бензол, ацетон).
Тепловий ефект процесу розчинення залежить від того, які стадії процесу розчинення переважають. Якщо переважають перші три стадії процесу розчинення то тепло поглинається (так як ці стадії фізичний процес), якщо переважає четверта стадія, то тепло виділяється (стадія гідратації або сольватації).
Так, процес гасіння вапна – екзотермічний процес
CaO+H2O 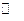 Ca(OH)2 +Q
Ca(OH)2 +Q
Розчинення натрій (III) нітрату (NaNO2) у воді ендотермічний процес
Якщо в розчин при даній температурі внести кристал розчиненої речовини і він розчинеться, то такий розчин називається ненасиченим.
Якщо при внесені в розчин додаткової кількості розчиненої речовини вона не розчиняється, то такий розчин називається насиченим.
Якщо при внесенні в гомогенний розчин кристала твердої речовини починається кристалізація розчиненої речовини, то такий розчин називається пересиченим. Якщо внести в пересичений розчин кристал ізоморфної речовини (кристалічна речовина, яка має подібний склад і кристалізується однаковій формі з близькими по величині кутами між гранями), або речовини, яка розчинена в розчині то розчин із пересиченого стає насиченим. Кристалізація починається в тому місці, в якому знаходиться внесений кристал, саме на гранях внесеного кристала.
Читайте також:
- А) Товар і його властивості.
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Аеродинамічні властивості колісної машини
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- Атрибутивні ознаки і властивості культури
- Білки, властивості, роль в життєдіяльності організмів.
- Біологічні властивості Т-залежних і Т-незалежних антигенів
- Біосфера Землі, її характерні властивості
- Біохімічні зміни в організмі при розтренуванні і перетренуванні
- Біохімічні основи розвитку витривалості
- Біохімічні основи розвитку силових і швидкісних якостей
| <== попередня сторінка | | | наступна сторінка ==> |
| Захисні покриття | | | Вода. Методи пом’якшення води |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |