
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
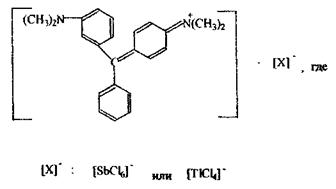
Характеристика ХОС.
Схема хроматографа
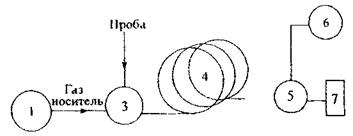
Схема поділу суміші спиртів С1 – С5
(у вигляді алкілнітритів)
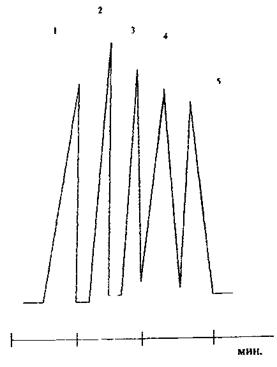
1 - метанол
2 - етанол -
3 - пропанол
4 - бутанол
5 - ізоаміловий спирт
Тема: ГРУПА РЕЧОВИН, ЯКІ ІЗОЛЮЮТЬСЯ З БІОЛОГІЧНОГО МАТЕРІАЛУ МІНЕРАЛІЗАЦІЄЮ.
СУЧАСНІ ЗАГАЛЬНІ І ОКРЕМІ МЕТОДИ МІНЕРАЛІЗАЦІЇ
План лекції
1. Загальна характеристика групи ”металевих” отрут
2. Основні закономірності поводження в організмі
3. Сучасні методи мінералізації
4. Особливості деструктивної мінералізації біологічного матеріалу при дослідженні на меркурій
1. Загальна характеристика групи «металевих» отрут
Група речовин «металеві» отрути містить у собі сполуки барію, кобальту, ніколу, талію, мангану, хрому, цинку, аргентуму, плюмбуму, кадмію, купруму, бісмуту, меркурію, стануму, а також миш'яку і сурми. Сполуки металів досить поширені в природі, входять до складу організму (Мn, Сu, Со і т.д. є біогенними).
Метали та їх сполуки знайшли широке застосування в народному господарстві: виробництво металевих сплавів, скла, кераміки, лаків, фарб, гуми, хімічних реактивів, в сільському господарстві в якості пестицидів (барію хлорид, гранозан, купруму сульфат і т д), в медицині як лікарські препарати (барію сульфат, калію перманганат, аргентуму нітрат, осарсол і т д).
Причини отруєння « металевими “отрутами:
• Неправильне використання мідного, оцинкованого, кадмірованого посуду при збереженні харчових продуктів,
• Потрапляння дрібнодисперсних частинок при обробці металів,
• Потрапляння в їжу при обробці рослин пестицидами, що містять «Металеві» отрути,
• Медикаментозні отруєння (неправильне збереження, передозування)
2. Основні закономірності поведінки в організмі
Закономірності поведінки сполук металів в організмі. Вивчення цього питання необхідне для правильного вибору методу ізолювання, об'єктів дослідження, для оцінки часу зберігання «отрут» в об'єкті дослідження. Надходження в організм «металевих» отрут:
1) ШКТ (через рот),
2) Органи дихання (характерно для летких сполук: сурм'янистий гідроген, сульфід сурми, меркурію і його сполуки, дрібнодисперсного стану речовин),
3) Через шкіру (препарати меркурію, талію, кадмію),
4) Через плаценту і слизові (миш'як)
Всмоктування іонів металів в основному відбувається у верхньому відділенні тонкого кишковика. Деякі сполуки металів не всмоктуються в травному тракті в зв'язку з їх малою розчинністю, наприклад, барію сульфат. Метали можуть бути в крові в іонному виді (тоді відбувається активний транспорт) або у вигляді комплексів (можливо неактивне всмоктування).
В процесі метаболічних перетворень «металеві» отрути в організмі піддаються процесам окислювання, відновлення, кон'югації, гідролізу.
Розподіляються метали в шлунку, кишковику, печінці і нирках. Для більшості металів характерне нагромадження в м'яких тканинах, особливо в тих, котрі багаті сульфгідрильними угрупуваннями (печінка, нирки); крім того, аргентум накопичується в шкірі; плюмбум, барій, кадмій, миш'як - в плоских кістках.
Має значення характер отруєнь, так миш'як, меркурій при гострих отруєннях виявляються в нирках, печінці, при хронічних - у нігтях, волоссі, кістках.
Виділяються з організму метали в основному нирками (із сечею), ШКТ (через кишковик), деякі метали (миш'як, меркурій) - потовими і молочними залозами.
Токсична дія обумовлена тим, що катіони металів зв'язуються з амінокислотами, пептидами і білками організму, утворюючи при цьому міцні комплекси за рахунок реакційноздатних функціональних груп (-SН.-NН2 -СООН, -ОН).
Токсична дія окремих «металевих» отрут:
Манган - протоплазматична отрута, поражає ЦНС, нирки, легені, органи кровообігу,
Хром - нефротоксична, припікаюча дія, блокує ряд ферментів,
Аргентум - припікаюча дія, поражає ряд капілярів,
Купрум - нейро-, гемо-, нефротоксична, місцева припікаюча дія,
Цинк -ентеротоксична дія,
Бісмут - метгемоглобіноутворююча, нейро-, гепотсксична дія,
Меркурій - нейро-, нефротоксична дія,
Арсен - підвищує проникність і викликає параліч капілярів, викликає гемоліз, блокує тіолові ферменти,
Талій - протоплазматична отрута, нейротоксична дія,
Барій - підвищує проникність клітинних мембран і капілярів (смерть від серцево-судинної недостатності),
Плюмбум - нефротоксична дія, блокує ряд ферментів.
3. Сучасні методи мінералізації
Вибір об'єкту хіміко-токсикологічного аналізу на «металеві» отрути залежить від їхнього розподілу і депонування в органах і тканинах. При ненаправленому аналізі на всі «металеві» отрути беруть шлунок з вмістом, тонку і товсту кишку з вмістом, печінку, нирки, сечу, селезінку. При направленому аналізі на деякі «металеві» отрути додатково до вищевказаних об'єктів досліджують :
· Пряму кишку, волосся (сполуки меркурію),
· Плоскі кістки (сполуки плюмбуму),
· Плоскі кістки і волосся (сполуки талію),
· Волосся, нігті, плоскі кістки (сполуки арсену);
· Мозок, легені (тетраетилсвинець)
Підготовка об'єкту до мінералізації:
Обрані об'єкти подрібнюють роздільно і піддають дослідженню. Рідкі об'єкти, наприклад сечу, вимірюють. Якщо об'єкт консервований етиловим спиртом (застосування в цих цілях формальдегіду або фенолу не допускається), його слабко підлужнюють карбонатом натрію (для розкладання летких хлоридів арсену і меркурію), поміщають у порцелянову чашку і спирт відганяють на водяній бані при температурі не вище 50° С.
Наважка об'єкту залежить від загальної ваги об'єкту дослідження, обставин справи й інших факторів Наприклад, якщо відомо, що померлий жив після отруєння порівняно довгий час, протягом якого відбувалося виділення прийнятої речовини, або маються дані на малу дозу прийнятої речовини, необхідно брати якможна більшу кількість об'єкту. Коли такі вказівки відсутні, в більшості випадків беруть 100 г органів .
При малих кількостях об'єктів буває необхідність у використанні для мінералізації також залишків після дистиляції з водяною парою, надлишок води видаляють обережним випаровуванням на водяній бані.
Паралельно з проведенням мінералізації досліджуваного об'єкта іноді виникає необхідність у сліпому досвіді для контролю чистоти реактивів.
Необхідність мінералізації об'єктів дослідження при ізолюванні «металевих» отрут викликається тим, що катіони металів мають здатність вступати в сполуки з білками, амінокислотами, пептидами й утворювати з ними досить міцні комплекси. Метали в таких комплексах знаходяться в зв'язаному стані і не можуть бути виявлені без попередньої мінералізації біологічного матеріалу.
Мінералізація являє собою окислювання (спалювання) органічної речовини, що складає об'єкт дослідження, з метою руйнування комплексів металів з білками, після чого «металеві» отрути переходять у розчин в іонному виді.
Існують методи «сухої» і «мокрої» мінералізації. До методів «мокрої» мінералізації відноситься рідиннофазне окислювання сумішами кислот (сірчаною й азотною; сірчаною, азотною і хлорною), до «сухої» мінералізації відносять спалювання, сплавлення із поташем та селітрою.
Методи мінералізації можна розділити на загальні і окремі До загальних методів звичайно відноситься мінералізація за допомогою кислот. Методи «сухої» мінералізації застосовуються головним чином як окремі методи. До окремих методів відноситься також деструктивна мінералізація, яка використовується для ізолювання неорганічних сполук меркурію.
Найбільш широке застосування в даний час одержав метод мінералізації сумішшю сірчаної й азотної кислот, за кордоном також широко використовується метод мінералізації сумішшю сірчаної, азотної і хлорної кислот. Обидва методи характеризуються відносною швидкістю, повнотою руйнування органічних речовин, дозволяють одержати досить малі об’єми мінералізату. Недоліком методів є значні втрати меркурію за рахунок летючості її сполук. Крім того, метод з використанням суміші сірчаної, азотної і хлорної кислот, будучи найбільш швидким, вибухонебезпечний.
Методи «сухої» мінералізації використовують як окремі при дослідженні на деякі «металеві» отрути (аргентум, плюмбум, марганець, цинк) у невеликих наважках об'єктів (волосся, шкіра, пігулки і т.д.). Недоліком методів є втрата сполук меркурію.
Мінералізація сумішшю сірчаної й азотної кислот.
У колбу Кьєльдаля місткістю 500-800 мл вносять 100 г подрібненого біологічного матеріалу, додають 75 мл суміші, що складається з рівних об’ємів концентрованих азотної і сірчаної кислот і води. Над колбою Кьєльдаля закріплюють ділильну лійку, у якій міститься концентрована азотна кислота, розведена рівним об’ємом води, нагрівання проводять за допомогою газового пальника.
На початку мінералізації концентрована сірчана кислота відіграє роль водовіднімаючого засобу, порушуючи структуру клітин і тканин. При підвищенні температури (вище 110° С) і концентрації (до 60-70 %) сірчаної кислоти, вона проявляє окисні властивості і розкладається з виділенням оксиду сірки (IV)
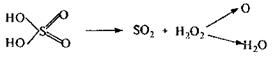
Спочатку азотна кислота виступає слабким окислювачем. З утворенням оксидів азоту й азотистої кислоти, а також з підвищенням температури азотна кислота проявляє себе як сильний окислювач
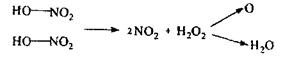
У процесі мінералізації утворюється деяка кількість нітрозілсірчаної кислоти, що заважає виявленню деяких металів

При нагріванні ароматичних речовин із сумішшю сірчаної й азотної кислот йдуть небажані побічні процеси нітрування і сульфування, що затруднює мінералізацію. Попереднє розведення водою сірчаної й азотної кислот перед мінералізацією значно зменшує ступінь нітрування і сульфування.
Мінералізація проходить у дві стадії:
У першій стадії, яка має назву «деструкція», відбувається порушення структури біологічного матеріалу під впливом кислот - окислювачів (без повного руйнування органічних речовин), а також руйнування комплексів металів з білками, в результаті чого метали переходять в розчин-деструктат у вигляді іонів. В деструктаті також знаходяться продукти розпаду органічних речовин : білкові молекули, пептиди, амінокислоти, ліпіди і деякі інші речовини, що входять до складу тканин організму Стадія деструкції закінчується за 30-40 хв, протікає при несильному нагріванні. Деструктат являє собою важку прозору рідину, що має жовтувате або буре забарвлення.
В другій стадії мінералізації відбувається повне руйнування органічних речовин. Ця стадія більш тривала (тривалість її лімітується руйнуванням жирів), протікає при більш сильному нагріванні (колба Кьєльдаля опущена на азбестову сітку) і при додаванні по краплях азотної кислоти.
Мінералізацію вважають завершеною, коли після припинення додавання азотної кислоти при нагріванні колби будуть виділятися білі пари сірчаної кислоти і не буде відбуватися почорніння мінералізату.
Денітрація - процес звільнення мінералізатів від азотної, азотистої, нітрозілсірчаної кислот і оксидів азоту. Ці речовини є окислювачами, які заважають подальшому аналізу на "металеві" отрути
Розроблено різні методи денітрації. Гідролізний метод (застосовується на перших етапах), заснований на розведенні мінералізатів водою з послідуючим нагріванням отриманих рідин. При цьому улетючуються азотна, азотиста кислоти, оксиди азоту, а нітрозілсірчана кислота піддається гідролізу
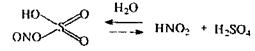
Метод тривалий, потрібно 15-17 годин.
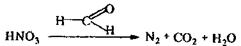
|
Для денітрації мінералізатів пізніше запропоновані відновники (сечовина, сульфіт натрію, формальдегід). Кращим реагентом є формальдегід, оскільки руйнування окислювачів відбувається швидко (1-2 хв), надлишок відновника легко видаляється кип'ятінням на протязі декількох хвилин.
Хімізм процесів, що відбуваються:

|
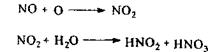
Для руйнування нітрозілсірчаної кислоти попередньо мінералізат розбавляють водою і нагрівають до 110° С, а потім додають формалін.
Перевірку повноти денітрації проводять по реакції з дифеніламіном. При наявності окислювачів з'являється синє забарвлення.
|
Необхідний сліпий дослід, тому що в сірчаній кислоті (у якій розчиняють дифеніламін для досліду) може міститися азотна кислота.
По зовнішньому вигляді мінералізат в більшості випадків являє собою безбарвну, прозору і досить важку рідину. Іноді мінералізат буває забарвлений у жовтуватий (за рахунок катіонів заліза (III), що входять до складу тканин організму), зеленуватий (при наявності хрому (III)) або блакитний (за рахунок міді (II)) кольорів. Нерідко мінералізат містить білий (за рахунок сульфатів плюмбуму, барію або кальцію) або брудно-зелений (за рахунок співосаждення сульфату хрому (III)) осад.
4. Особливості деструктивної мінералізації біологічного матеріалу при дослідженні на меркурій.
Деструктивна мінералізація - окремий метод мінералізації, який застосовується при хіміко-токсикологічному аналізі на неорганічні сполуки меркурію. Необхідність використання окремого методу ізолювання зумовлена тим, що в процесі повної мінералізації меркурій втрачається, тому проводять не повне руйнування органічних речовин, а часткове, спрямоване на розрив зв'язку між меркурієм і білками. Мінералізацію закінчують на стадії деструкції.
Об'єктами дослідження на неорганічні сполуки меркурію є 20 г печінки, 20 г нирок. Ізолювання проводять роздільно. Як окислювачі використовують суміш с сірчаної й азотної (сірчаної, азотної і хлорної) кислот. Деструкцію проводять в присутності етилового спирту, що є каталізатором цього процесу. Нагрівання проводять на водяній бані протягом 10-15 хв. Таким чином, після деструкції біологічного матеріалу в деструктаті знаходяться іони ртуті, білки, пептиди, амінокислоти, ліпіди й ін.
Для видалення з деструктату окислювачів використовують сечовину.
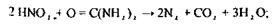
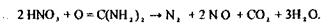
|
Отриманий деструктат досліджують на наявність ртуті.
Тема: ДРОБНИЙ МЕТОД АНАЛІЗУ МІНЕРАЛІЗАТУ НА «МЕТАЛЕВІ» ОТРУТИ. КІЛЬКІСНЕ ВИЗНАЧЕННЯ «МЕТАЛЕВИХ» ОТРУТ В МІНЕРАЛІЗАТІ.
План лекції
1. Основні положення дробного методу аналізу. Прийоми «маскування» іонів, що заважають.
2. Схема аналізу мінерачізату на «металеві» отрути по А.Н.Криловой. Виявлення меркурію в деструктаті.
3. Кількісне визначення «металевих» отрут
4. Атомно-абсорбційна спектрометрія при дослідженні «металевих» отрут.
1. Основні положення дробного методу аналізу. Прийоми «маскування
іонів, що заважають.
В хіміко-токсикологічному аналізі для виявлення іонів металів у мінералізатах застосовується систематичний хід аналізу і дробний метод. Систематичний хід аналізу (кислотний або сірководневий) заснований на послідовному поділі катіонів на аналітичні групи, підгрупи і виділенні окремих іонів з підгруп. Систематичний метод є тривалим, небезпечним, пов'язаний з великими втратами отрут, в даний час практично витіснений із практики хіміко-токсикологічного аналізу дробним методом.
Дробний метод заснований на застосуванні реакцій, за допомогою яких у будь-якій послідовності можна знайти шукані іони в окремих невеликих порціях досліджуваного розчину. Дробний метод є швидким, чутливим, дозволяє визначити «металеві» отрути без попереднього відділення їх один від одного. Основоположником дробного методу аналізу є Н А.Тананаєв, велика заслуга в розробці методик дробного методу і впровадженні їх у практику хіміко-токсикологічного аналізу належить А.Н.Криловой.
В основі дробного методу лежать такі прийоми:
• заміна осадження рідиннофазними реакціями комплексоутворення з послідуючою екстракцією і реекстракцією,
• використання найбільш чутливих і специфічних реакцій (наприклад на манган - окислювання до перманганат іонів, на хром -утворення надхромових кислот і т д),
• при недостатній специфічності реакцій, спочатку проводять попередню пробу, потім - підтверджуючі дослідження,
• «маскування» іонів, що заважають,- при цьому усувають заважаючий вплив іонів як природних, так і введених в організм.
Способи «маскування» іонів, що заважають:
• комплексоутворення; при цьому іони, що заважають, зв'язують у
безбарвні міцні комплекси: для маскування використовують ціаніди, фториди, фосфати, тіосульфати, тіосечовину, трилон Б, аскорбінову кислоту, гідроксиламін.
Наприклад, реакції на Со2+ з роданідом заважають Fе3+, для цього додають розчини фторидів або фосфатів, що зв'язують Fe3+ в безбарвні комплекси [FеF6 ]3 або [Fе(FО 4)2]3 ;
• оперування малими об’ємами або великими розбавленнями мінералізату для усунення впливу ендогенних іонів металів, для цих цілей мінералізат відразу розводять до 180 мл і використовують невеликі порції для виявлення окремих іонів: для Мn2+ - 1 мл, Сu2+ - 3 мл, Bi3+ - 10 мл і т.д.
• варіювання рН середовища; так комплекси з дитизоном свинець утворить тільки в лужному середовищі, у кислому середовищі комплекси з дитизоном утворять ртуть і срібло, при сильному підкисленні дитизонат срібла руйнується, а дитизонат ртуті - ні;
• застосування реакцій окислення-відновлення (перманганат іон переводять в іон мангану (II) при виявленні хрому по реакції з дифенілкарбазидом),
• використання ряду активності диетилдитіокарбамінатів (ДДТК) (свинець із ДДТК витісняється купрумом, купрум - меркурієм)
Найбільш часто застосовувані реактиви в дробному методі аналізу.
Дитизон.Дана сполука може бути в двох таутомерних формах:
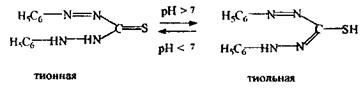
Існують різні точки зору про структури дитизонатів, найбільш ймовірна форма:
У кислому середовищі утворюються однозаміщені дитизонати, в сильно лужному - відбувається заміщення і другого атома водню.
Дитизонати забарвлені (забарвлення часто залежить від рН середовища), що використовується в якісному і кількісному аналізі «металевих» отрут. Комплекси з дитизоном розчинні в органічних розчинниках і руйнуються при дії кислот, що застосовують для виділення окремих катіонів з мінералізату.
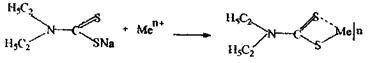
|
Диетилдитіокарбамати.Найчастіше як реагент використовують диетилдитіокарбамінат натрію, при взаємодії з яким катіони важких металів утворять внутрікомплексні сполуки:
Диетилдитіокарбамати добре розчинні в органічних розчинниках, багато з них безбарвні (диетилдитіокарбамати цинку, кадмію), деякі забарвлені (диетилдитіокарбамати купруму, бісмуту), руйнуються від додавання мінеральних кислот. Дані реакції використовують як попередні проби, для виділення катіонів з мінералізату, в кількісному аналізі «металевих» отрут.
Дифенілкарбазид . Даний реактив використовується для виявлення Сг3+ у мінералізаті. Попередньо Сг3+ окислюють персульфатом амонію в присутності каталізатора (іонів срібла) до дихроматів-іонів, що в свою чергу окислюють дифенілкарбазид (I) до дифенілкарбазону (П) При цій реакції Сr2О72 відновлюються до Сr2+, який в енольній формі дифенілкарбазону (III) дає внутрікомплексну сіль (IV), що має червоно-фіолетове забарвлення. Хімізм реакцій, що відбуваються:
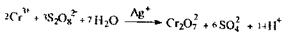
|
|

|
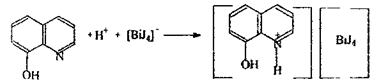
8-оксихінолін.Даний реактив використовується для виявлення бісмуту Ві3+. Попередньо іони бісмуту переводять в ацидокомплекс [ВіJ4 ] , що при взаємодії з оксином у кислому середовищі утворить іонний асоціат, при цьому спостерігають утворення оранжево-червоного осаду.

Малахітовий або брильянтово зелений.Дані реагенти використовують для виявлення сурми і талію. Попередньо сурму (знаходиться в мінералізаті у вигляді НSbО2) і талій (знаходиться в мінералізаті у вигляді Т13+) переводять в ацидокомплекси [SbС14 ] і [ТlСl4 ] . Останні з барвником утворюють забарвлені в синій абоблакитний колір іонні асоціати, що екстрагують толуолом або ксилолом:
2. Схема аналізу мінералізату на «металеві» отрути по А.Н.Криловій. Виявлення ртуті в деструктаті.
1 Відділення осадів РbSO4 і ВаSО4 від основного об’єму мінералізату -фільтрат 1.
2 Осад промивають водою, подкисленною сірчаною кислотою (для видалення співосаджених іонів Fе3+, Сu2+; Zn2+ , Cd2+і т.п.) Якщо осад має брудно-зелений колір, його промивають персульфатом амонію (для відмивання від Сr3+) Для розділення сульфатів барію і плюмбуму осад обробляють гарячим розчином ацетату амонію, РdSО4 розчиняється - фільтрат II:
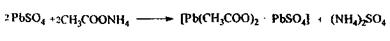
3 Дослідження осаду сульфату барію.
Перекристалізація сульфату барію з концентрованої сірчаноїкислоти; реакція чутлива, при негативному результаті дослідження на барій можна закінчити.

|
Реакція одержання осаду йодату барію:
забарвлення полум'я пальника в зелений колір

|
характерні безбарвні кристали
Реакція високочутлива, виявленню барію не заважають інші елементи.
4 Дослідження фільтрату II на РЬ2+. •
Реакція з дитизоном у лужному середовищі (рН 7,5-8,0); спостерігають червоне
забарвлення хлороформного шару.
Реакція попередня: при негативному результаті дослідження закінчують, при позитивному - проводять підтверджуючі реакції;
Після реекстракції РЬ2+ у водній фазі проводять реакції утворення осадів РbS; РbSO4 ,РbСrO4 ,РbJ2, спостерігаючи при цьому відповідно чорний, білий, оранжево-жовтий і жовтий осади; дані реакції підтверджуючі.
Дослідження фільтрату I.
5 Виявлення марганцю Мn2+.
Використовують дві специфічні реакції окислювання Мn2+ за допомогою перйодату калію і персульфату амонію до перманганат-іонів, що мають фіолетове забарвлення. В реакції з перйодатом калію для маскування іонів Fe3+,які заважають, використовують дигідрофосфат натрію:
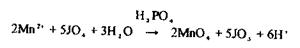
Реакція високочутлива (відкриває природній марганець, що є в організмі), має самостійне значення при негативному результаті, при позитивному - виконують підтверджуючу реакцію:
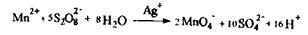
Реакція йде в присутності каталізатора - нітрату срібла, для маскування Fe3+ використовують дигідрофосфати.
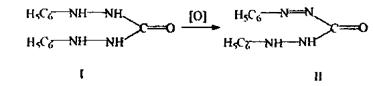
6. Виявлення Сr3+:
Реакція з дифенілкарбазидом (хімізм приведений вище), реакція високочутлива, але не специфічна. Для маскування іонів (заліза, сурми), що заважають, додають фосфати, перманганат-іони відновлюють за допомогою азиду натрію.
Реакція окислення Сr3+ до надхромових кислот, які мають синє забарвлення і більш стійкі в органічних розчинниках, ніж у воді:
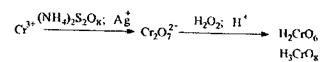
Дана реакція є специфічною на хром.
7. Виявлення Аg+ :
Утворення дитизонату срібла, у сірчанокислому середовищі спостерігають золотаво-жовте забарвлення хлороформного шару. Для відрізняння від дитизо-нату ртуті (забарвлений в оранжево-жовтий колір) дитизонат срібла розкладають 0,5 н розчином хлороводневої кислоти, дитизонат ртуті в цих умовах не розкладається.
При позитивному результаті цієї реакції срібло осаджують із всього об’єму мінералізату у вигляді АgCl↓. Осад відфільтровують і піддають підтверджуючим дослідженням. Осад обробляють розчином аміаку:

Потім проводять реакцію з азотною кислотою, спостерігають утворення
білого осаду:
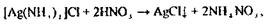
реакцію з йодидом калію, спостерігають жовтий осад.
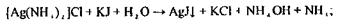
реакцію з тіосечовиною і пікратом калію, спостерігають утворення жовтих призматичних кристалів.
8 Виявлення Си2+:
реакція з (ДДТК)2 Рb - реактив специфічний на Сu2+ (згідно з правилом рядів Тананаєва плюмбум витісняють з комплексу, окрім міді, тільки срібло і ртуть). Спостерігають жовто-коричневе забарвлення хлороформного шару. При позитивному результаті реакції реекстрагують мідь у водний шар за допомогою НgСl2і проводять підтверджуючі дослідження:
реакція з пірідин-родановим реактивом:

смарагдово-зелений осад, що розчиняється в хлороформі;
реакція з гексаціаноферратом (ІІ) калію:

реакція с тетрароданомеркуроатом амонію:
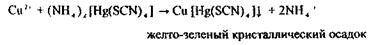
9. Виявлення Ві3+ •
виконують дві попередні реакції з 8-оксихіноліном (хімізм приведений вище) і тіосечовиною. При взаємодії іонів бісмуту з тіосечовиною утворюються комплекси різного складу, що мають лимонно-жовте забарвлення.
При позитивному результаті цих реакцій Ві3+ виділяють з мінералізату у вигляді (ДДТК)3Ві, реекстрагують за допомогою азотної кислоти і з реекстрактом проводять підтверджуючі дослідження: реакцію з тіосечовиною; відновлення іонів бісмуту Ві3+ до металевого бісмуту за допомогою цинкового пилу; одержання кристалічних осадів із бруцином і бромідом калію, з хлоридом цезію і иодидом калію.
10. Виявлення Zп2+:
реакція з дитизоном, є попередньою (рН 4,5 - 5,0); при позитивному результаті даної реакції цинк виділяють з мінералізату у вигляді диетилдитіокарбамінату і після реекстракції проводять підтверджуючі дослідження:
реакція утворення сульфіду цинку:


|
Реакція з гексаціаноферратом (II) калію:
реакція з тетрароданомеркуроатом амонію:
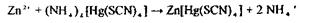
|
11. Виявлення Sb3+ та Tl3+:
Попередня реакція з малахітовим або бриліантовим зеленим (хімізм приведений вище). При позитивному результаті проводять підтверджуючі дослідження:
Для сурми - одержання осаду сульфіду сурми Sb2S3:
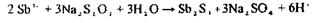
оранжевий осад
Для талію (після переведення Тl3+ в Тl) проводять реакцію з дитизоном .
12. Виявлення Сd2+.
виділяють кадмій з мінералізату у вигляді (ДДТК)2Сd, який переходить у хлороформний шар, потім розкладають його хлороводневою кислотою. В солянокислому реекстракті кадмій виявляють по реакції із сульфідом натрію
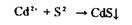
жовтий осад
Проводять реакції одержання кристалічних осадів із бруцином і бромідом калію, з пірідином і бромідом калію.
13 Виявлення миш'яку
Дослідження на миш'як починають з реакції Гутцайта або Зангер-Блека Реакція базується на переведенні миш'яку в миш’яковистий водень і виявленні останнього реакцією з реактивним папером, просоченим бромідом ртуті:
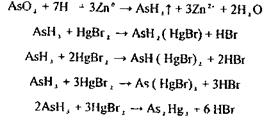
У присутності миш'яку реактивний папір набуває жовтого або буро-коричневого забарвлення. Реакція високо чутлива (0,1 мкг в аналізованій пробі мінералізату) але не специфічна (заважає РН3, SbН3), тому вимагаються підтверджуючі дослідження.
Одним із самих характерних хіміко-токсикологічних досліджень на миш'як є аналіз мінералізату за допомогою апарату Марша. Дослідження в апараті Марша починають з постановки «сліпого» досліду з реактивами. Таким чином підтверджують відсутність миш'яку в сульфатній кислоті, цинку, склі. «Сліпий» дослід проводять в таких же умовах, як і дослід з мінералізатом. При відсутності миш'яку в реактивах і приладі їх можна використовувати для аналізу мінералізату.
Миш’яковистий водень визначають за такими ознаками:
1 за часниковим запахом,
2 за синім забарвленням полум'я при підпалюванні АsН3,
3 за помутнінням розчину АgNО3 при пропусканні в нього АsН3,
4 за нальотом на порцеляновій пластинці при внесенні її в полум'я палаючого АsН3.
Основний іспит - це термічне руйнування АsH3, у вузькій частині трубки Марша.

Наліт, що утворюється, (за місцем нагрівання) випробують додатково. Трубку відокремлюють від приладу, нагрівають наліт при доступі кисню повітря.

Утворений миш’яковистий ангідрид має вигляд характерних кристалів у вигляді октаедрів.
Переваги методу:
• багаторазовість перевірки мінералізату на миш'як,
• наочність використовуваних проб.
Недолік:
• тривалість, небезпека вибуху при попаданні в систему кисню повітря.
Специфічність методу:
• виявленню миш'яку можуть заважати сурма, сірка, вуглець. Однак сурм'янистий ангідрид - аморфний осад, а оксиди вуглецю і сірки - леткі. Є й інші методи розпізнавання миш'яку і сурми, засновані на використанні мікрокристалічних реакцій.
14. Виявлення ртуті в деструктаті:
реакція з дитизоном після попереднього екстракційного очищення деструктату (неспецифічна реакція);
реакція із суспензією одновалентної йодистої міді:

Утворюється тетрайодмеркуроат міді (I), який має вигляд рожевого або оранжево-червоного осаду; дана реакція є чутливою і специфічною.
3. Кількісне визначення «металевих» отрут.
При виявленні «металевих» отрут у мінералізаті на більшість з них потрібно проведення кількісного визначення, що зумовлено природним вмістом багатьох елементів (марнган, мідь, цинк, хром) в організмі або нагромадженням їх у процесі життєдіяльності (миш'як, ртуть, свинець).
Використовують наступні методи кількісного визначення: гравіметричний (для барію - у вигляді осаду ВаSО4); титриметричні: комплексонометричний (барій, свинець, цинк, мідь, бісмут, кадмій), йодометричний (свинець), аргентометричний (миш'як), роданометричний (срібло); фотоколориметричний (марганець - по реакції з перйодатом калію; ртуть, свинець, срібло, талій, цинк - по реакції з дитизоном; талій, сурма - по реакції з малахітовим або брильянтовим зеленим; хром - по реакції з дифенілкарбазидом; мідь - по реакції з диетилдитіокарбамінатом свинцю; бісмут - по реакції з тіосечовиною); візуальний колориметричний (ртуть - по реакції із суспензією йодистої міді; миш'як - проба Зангер-Блека); атомно-абсорбційний метод можна використовувати як для якісного, так і кількісного аналізу всіх металів.
4. Атомно-абсорбціна спектрометрія при дослідженні «металевих» отрут.
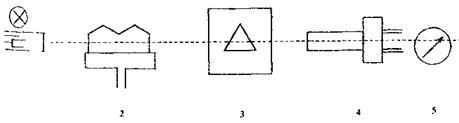
|
Атомно-абсорбційна спектрометрія - метод кількісного елементного аналізу за атомними спектрами поглинання (абсорбції). Через шар атомних парів проби, одержуваних за допомогою атомізатора, пропускають випромінювання в діапазоні 190-850 нм. В результаті поглинання квантів світла атоми переходять у збуджені енергетичні стани. Цим переходам в атомних спектрах відповідають так звані резонансні лінії, характерні для даного елемента. Згідно з законом Бугера-Ламберта-Бера, мірою концентрації елемента служить оптична густина А = lg(J0/J)де J0 і J - інтенсивності випромінювання від джерела відповідно до і після проходження через поглинаючий шар.
Принципова схема атомно-абсорбційного спектрометра:
1 джерело випромінювання, 4 - фотопомножувач:
2 полум'я; 5 - пристрій, який реєструє.
3 монохроматор;
Переведення аналізованого об'єкту в атомізований стан здійснюється в атомізаторі - переважно в полум'ї або трубчастій печі. Найбільш часто використовують полум'я сумішей ацетилену з повітрям (t ≈ 2000° С) і ацетилену з закисом азоту (t ≈ 2700° С). Джерелом випромінювання найчастіше служать лампи з полим катодом, заповнювані неоном.
Атомно-абсорбційну спектроскопію застосовують для визначення близько 70 елементів, головним чином металів.
Межі виявлення більшості елементів у розчинах 1-100 мкг/л (при атомізації в полум'ї), 0,1-100 мкг/л (при атомізації в графітовій печі). Точність вимірів від 0,2 до 1,0 %. В автоматичному режимі полум'яний спектрометр дозволяє аналізувати до 500 проб в годину, а спектрометр із графітовою піччю — до 30 проб.
Тема: ГРУПА РЕЧОВИН, ЯКІ ІЗОЛЮЮТЬСЯ З БІОЛОГІЧНОГО МАТЕРІАЛУ ЕКСТРАКЦІЄЮ ОРГАНІЧНИМИ РОЗЧИННИКАМИ – ПЕСТИЦИДИ
План лекції
1. Загальне поняття про пестициди. Народногосподарське значення пестицидів Негативні фактори впливу пестицидів на людину таі навколишнє середовище.
2. Класифікація, пестицидів.
3. Фізико-хімічні властивості, основні закономірності поведінки в організмі, токсична дія на організм пестицидів: хлорорганічних (ХОС) і токсичних ефірів фосфорної кислоти (ФОС).
4. Методи хіміко-токсикологічного аналізу об'єктів біологічного походження на ХОС і ФОС.
1. Загальне поняття про пестициди. Народногосподарське значення
пестицидів. Негативні фактори впливу пестицидів на
людину й навколишнє середовище.
Слово пестициди походить від двох латинських слів: pestis - зараза, чума, cido – вбиваю. Зазначені речовини використовуються для боротьби з різними мікроорганізмами, грибами, комахами, гризунами, бур'янами. Застосування пестицидів у рослинництві сприяє захисту та підвищенню врожайності сільськогосподарських культур.
За підрахунками фахівців своєчасне проведення заходів щодо захисту рослин дозволяє зберегти з кожного гектара 2-3 ц зерна, не менш 5ц рису.
Застосування пестицидів сприяє викорінюванню таких захворювань, як малярія, черевний тиф і ін.
Пестициди поряд з позитивними властивостями мають і негативні сторони: вони токсичні для людини і тварин, корисних комах і рослин; деякі накопичуються в навколишньому середовищі, володіючи високою стійкістю, порушують екологічну рівновагу.
У 1939 р. швейцарський біохімік П.Мюллер випадково синтезував наймогутніший інсектицид ДДТ - дихлордифенілтрихлоретан. Оброблена ДДТ білизна зберігала інсектицидний ефект після 6-7 прань. Ефект обробки засіків і приміщень зберігався до 4 років. Однак поступово замилування ДДТ стало змінюватися тривогою. Препарат накопичувався в ґрунті, живих істотах, що населяють наш світ. ДДТ зберігається в навколишньому середовищі понад 10 років. Проникнув ДДТ і в організм людини. До ДДТ стали з'являтися стійкі побутові шкідники.
В усьому світі зафіксовані випадки гострих і хронічних отруєнь токсичними ефірами фосфорних кислот, тобто фосфоровмісними органічними сполуками. Відзначені випадки смертельних отруєнь хлорофосом, карбофосом, трихлорметафосом, фосфамідом і багатьма іншими пестицидами.
2. Класифікація пестицидів
Існують різні типи класифікації пестицидів:
• за призначенням;
• за характером проникнення в організм;
• за хімічною структурою;
• за токсичністю;
• за стійкістю.
В залежності від призначення існують: інсектициди, фунгіциди, зооциди, акаріциди, нематоциди, бактерициди, гербіциди, регулятори росту, дефомганти, реппеленти, атрактанти й ін.
За характером проникнення в організм пестициди бувають: контактні, дихальні (фумиганти), кишкові, системні.
За токсичністю пестициди поділяються на:
•. отруйні: з DL50 до 50 мл/кг;
• високотоксичні: DL50 до 50-200 мл/кг,
• середньотоксичні: DL17 200-1000 мг/кг;
• малотоксичні: DL50 більш 1000 мг/кг.
За стійкістю пестициди бувають:
• дуже стійкі (період розкладання понад 2 років);
• стійкі (з періодом розкладання 0,5 - 1 рік),
• помірно стійкі (1 -6 місяців);
• малостійкі (1 місяць).
За хімічною структурою пестициди поділяють на неорганічні й органічні. Органічні в свою чергу поділяють: на фосфорвмісні органічні сполуки (ФОС); хлорорганічні (ХОС), похідні карбамінової кислоти, металорганічні пестициди, наприклад РОС (ртутьвмісні) і т.д.
Найбільш зручна класифікація пестицидів для токсикологічної хімії - це класифікація за хімічною структурою. Зупинимося на короткій характеристиці окремих хімічних груп пестицидів.
3. Фізико-хімічні властивості, основні закономірності поведінки в організмі, токсична дія представників ХОС і ФОС.
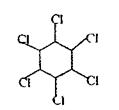
Хімічна будова.ХОС різні за хімічною будовою, але їх поєднує наявність атомів хлору в органічній молекулі. Всі ХОС можна підрозділити на три групи:
• Група ДДТ
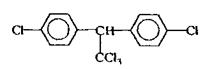
|
• Група гексахлорциклогексану (гексахлорану)
• Група поліхлорциклодієнів
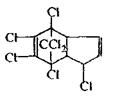
Гептахлор
Фізико-хімічні властивості. ХОС - тверді речовини, не розчиняються або незначно (слабко) розчиняються у воді, добре - в органічних розчинниках, леткі, дуже стійкі сполуки: не руйнуються при кип'ятінні, навіть у присутності соди. ХОС ліпідорозчинні неелектроліти.
Встановлено, що після 7 років обробки ґрунту в ньому ще зберігається 29 % первинної кількості ХОС, в другому випадку було визначено 80 % вихідної кількості. ДДТ і деякі інші ХОС можуть зберігатися в ґрунті 10 і більш років. (Стійкість у навколишньому середовищі називають персистентністю). Такі ХОС, як ДДТ, альдрин, дилдрин заборонені для використання. Заборона на застосування ДДТ у сільському господарстві СРСР була введена у 1968 р.
Основні закономірності поведінки в організмі. В організм ХОС надходять через рот з їжею і водою, через дихальні шляхи з повітрям, через шкіру при контакті з препаратами, проникають через плаценту від матері до дитини.
Приклади отруєння ХОС.
У літературі описаний випадок отруєння жінки і двох її дітей у віці 1 року і 7 років компотом, звареним з ягід смородини й аґрусу, зібраних з кущів, оброблених ДДТ. Дитина 7 років загинула при явищах гіпертермії і клоніко-тонічних судорогах. Стан однорічної дитини залишався важким протягом 4 днів, а потім поступово покращився. Мати видужала на шосту добу.
Описаний випадок смертельного отруєння робітника, пролившого собі на одяг суспензію хлордану.
Розподіл в організмі. ХОС накопичуються в тканинах і органах, створюючи в них «депо» пестицидів, в основному в жирових тканинах. З «депо» ХОС можуть надходити в кров протягом тривалого часу (іноді до декількох років).
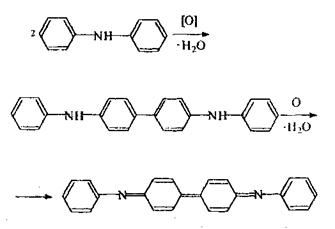
Метаболізм. ХОС в організмі піддаються перетворенням, наприклад: гептахлор перетворюється в епокис гептахлору, котрий володіє ще більшою токсичністю, ніж нативна сполука, ДДТ втрачає хлор - перетворюється в ДДЕ, потім окислюється з утворенням дихлордифенілоцтової кислоти (ДДО).
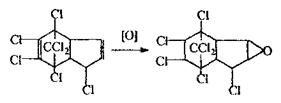
|
Хімізм процесів метаболізму.
Епокись гептахлору
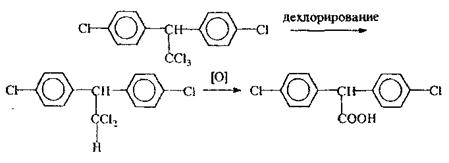
|
Виділення. ХОС з організму виділяються із сечею, калом, грудним молоком. У зв'язку з останнім можливо отруєння дітей грудного віку материнським молоком.
Механізм токсичної дії на організм людини до кінця не з'ясований. Думають, що початковим фактором дії ХОС служить гноблення ферментних систем організму. Відбувається ушкодження мембран клітин внаслідок переокислення ліпідів; порушення обмінних процесів.
Смертельна доза ХОС коливається від 5 до 60 р.
Читайте також:
- I. Загальна характеристика політичної та правової думки античної Греції.
- II. ВИРОБНИЧА ХАРАКТЕРИСТИКА ПРОФЕСІЇ
- II. Морфофункціональна характеристика відділів головного мозку
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Автобіографія. Резюме. Характеристика. Рекомендаційний лист
- Автокореляційна характеристика системи
- Амплітудно-частотна характеристика, смуга пропускання і загасання
- Аплікація як вид образотворчої діяльності дошкільнят, його характеристика.
- Архітектура СЕП та характеристика АРМ-1, АРМ-2, АРМ-3
- Афіксальні морфеми. Загальна характеристика
- Банківська система України і її характеристика
- Банківські ризики та їх характеристика
| <== попередня сторінка | | | наступна сторінка ==> |
| Самописець. | | | Характеристика ФОС |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |