
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
КЛАСИФІКАЦІЯ І ХАРАКТЕРИСТИКА ОРГАНІЧНИХ РЕАКЦІЙ
Замісники І роду (електронодонорні), що підвищують електронну густину бензенового кільця (особливо в о- і n-положеннях) за рахунок власної електронної пари, яка вступає у спільне спряження з p-електронною хмарою бензеного кільця. Завдяки загальному збільшенню електронної густини виявляється прискорюючий ефект на швидкість реакцій електрофільного заміщення SE. Такі замісники називаються активуючими.
Оскільки електронодонорний замісник утворює з кільцем загальну спряжену систему, то відбувається перерозподіл електронної густини таким чином, що найбільша її частина зосереджується в о- і n-положеннях на атомах С – з цієї причини їх часто називають орто- і пара-орієнтантами (рис. 9.8, рис. 9.10). За рахунок виникнення часткових негативних зарядів (d–) ці атоми карбону стають центрами електрофільної атаки. До того ж полярність зв¢язків С–Н в о- і n-положеннях збільшується, тому зростає рухливість атомів Н, що полегшує їх заміщення.

Рисунок 9.8 – Орієнтуючий вплив електронодонорних замісників І роду, які збільшують електронну густину на атомах карбону в о- і п-положеннях бензенового кільця, внаслідок чого на них виникають часткові негативні заряди (d–)
До електронодонорних замісників належать атоми і атомні групи з позитивним мезомерним (+М) чи індуктивним (+І) ефектом (табл. 9.1).
Серед замісників І роду окреме місце займають галогени, які хоч і виявляють о- і n-орієнтуючу дію, але на відміну від інших електронодонорних замісників ускладнюють вступ нового замісника і сповільнюють швидкість реакції SE для заміщених аренів порівняно із швидкістю реакцій SE за участю чистого бензену. Така особливість галогенів поснюється тим, що їх негативний індуктивний ефект за абсолютною величиною перебільшує позитивний мезомерний ефект | –I| > |+M|.
Подвійний (о- і n-) орієнтуючий вплив електронодонорних замісників приводить до утворення внаслідок реакцій SE суміші ізомерів, серед яких у переважній кількості знаходяться о- і п-продукти, наприклад:
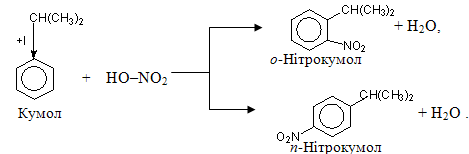
Замісники ІІ роду (електроноакцепторні) – це мета-орієнтанти, які знижують електронну густину бензенового кільця і зменшують швидкість реакцій електрофільного заміщення. Їх називають дезактивуючимизамісниками (табл. 9.1). Замісниками ІІ роду є атоми і атомні групи, які відтягують p-електронну хмару бензенового кільця на себе завдяки негативному мезомерному (–М) чи негативному індуктивному (–І) ефекту. Тому електронна густина на бензеновому кільці зменшується і внаслідок її перерозподілу лишається дуже незначний за величиною частковий негативний заряд (d–) на атомах карбону в мета-положеннях (рис. 9.9).

Рисунок 9.9 – Орієнтуючий вплив електроноакцепторних замісників ІІ роду, які зменшують p-електронну густину бензенового кільця, лишаючи дуже незначний за величиною частковий негативний заряд (d-) на атомах карбону в мета-положеннях
Таблиця 9.1 – Вплив замісників на реакційну здатність та напрямок реакцій електрофільного заміщення в ароматичному кільці
| Замісники | Тип електрон-ного ефекту | Вплив на реакційну здатність* | Переважна орієнтуюча дія |
| Замісники І роду | |||
| –NH2, –NHR, –NR2, –OH | +M >> –I | + + + | o-, n- |
| –O– | +M, +I | + + + | o-, n- |
| –NHCOCH3, –ОCOCH3, –OCH3, (–OR) | +M > –I | + + | o-, n- |
| –CH3, –CnH2n+1 | +I | + | o-, n- |
| –C6H5, –CH=CH2, –CºCH | +M > –I | + | o-, n- |
| –F, –Cl, –Br, –I, –CH2Cl, –CH=CHNO2 | +M < –I | – | o-, n- |
| Замісники ІІ роду | |||
| –CN, –CH=O, –COR, –COOH, –COONH2, –COOR, –SO3H | –I, –M | – – | м- |
| –NR3+, –CF3, –CCl3 | –I | – – – | м- |
| –NO2, –N2+ | –I , –M | – – – | м- |
* Активують сильно ( + + +), помірно ( + +) , слабо (+);
дезактивують сильно (– – –), помірно (– –), слабо (–).
Замісники ІІ роду зменшують реакційну здатність кільця в реакціях SE, однак напрямлюють нові електрофільні групи у мета-положення, при цьому реакції SE протікають дуже повільно. Наприклад, швидкість реакції нітрування нітробензену, який містить замісник ІІ роду, в 10000 разів менша, ніж швидкість нітрування самого бензену:
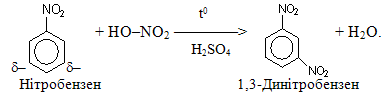
Правила орієнтації дозволяють передбачити переважний напрямок перебігу реакції, однак вони рідко виконуються з абсолютною точністю. У продуктах реакції можуть одночасно міститися о-, n- і м-ізомери, але їх відносна кількість буде різною. Наприклад, при нітруванні толуолу продукти утворюються у таких масових співвідношеннях (зазначені на схемі у дужках):

Відносна реакційна здатність і, як наслідок, швидкість реакцій електрофільного заміщення монозаміщених ароматичних сполук може змінюватися у широкому діапазоні. Вона визначається як природою самого замісника, так і характером реагенту і умовами реакції. Наприклад, швидкість бромування, хлорування і нітрування толуолу відповідно у 600; 300 і 30 разів більша, ніж швидкість цих реакцій з бензеном.
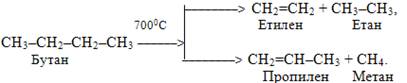
Величезна кількість органічних реакцій, які характеризуються різними ознаками, сприяє існуванню достатньо багатьох класифікацій. При цьому, залежно від ознаки, що розглядається (чи вивчається), одна і та сама органічна реакція може одночасно належати до декількох типів. Більшість процесів піддається класифікації, що значно полегшує їх вивчення, однак в органічній хімії зустрічаються складні реакції, які неможливо віднести до будь-якого з перелічених типів. Як приклад можна навести піроліз – розщеплення складних органічних сполук на простіші при високих температурах. При піролізі одночасно відбувається велика кількість різних реакцій: крекінг (розщеплення у карбоновому ланцюгу зв‘язків С–С і С–Н), дегідрогенізація (відщеплення атомів Н), полімеризація, ізомеризація тощо. Наприклад, піроліз алканів–хімічне перетворення алканів при підвищених температурах:
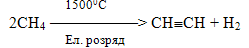
Читайте також:
- I. Загальна характеристика політичної та правової думки античної Греції.
- II. ВИРОБНИЧА ХАРАКТЕРИСТИКА ПРОФЕСІЇ
- II. Класифікація видатків та кредитування бюджету.
- II. Морфофункціональна характеристика відділів головного мозку
- V. Класифікація і внесення поправок
- V. Класифікація рахунків
- А. Структурно-функціональна класифікація нирок залежно від ступеню злиття окремих нирочок у компактний орган.
- Аварії на хімічно-небезпечних об’єктах та характеристика зон хімічного зараження.
- Автобіографія. Резюме. Характеристика. Рекомендаційний лист
- Автокореляційна характеристика системи
- Адміністративні провадження: поняття, класифікація, стадії
- Амплітудно-частотна характеристика, смуга пропускання і загасання
| <== попередня сторінка | | | наступна сторінка ==> |
| МЕЗОМЕРНИЙ ЕФЕКТ | | | РОЗРИВУ ХІМІЧНИХ ЗВ’ЯЗКІВ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |