
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Тепловий ефект реакції залежить тільки від вигляду і стану початкових і кінцевих продуктів, але не залежить від проміжних станів та шляхів переходу початкових речовин до кінцевих.
Закон Гесса є окремим випадком першого закону термодинаміки, що застосовується до хімічних процесів, які протікають в ізохорних або ізобарних умовах.
Як приклад, що підтверджує закон Гесса, розглянемо реакцію утворення діоксиду карбону. Він утворюється при безпосередньому спалюванні вугілля (графіту), але можна також провести процес в дві стадії, одержуючи на першій з них СО і, спалюючи його на другій стадії до СО2.
С (графіт) + О2 (г) = СО2 (г); ΔН1
С (графіт) + 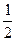 О2 (г) = СО(г) ; ΔН2
О2 (г) = СО(г) ; ΔН2
СО(г) + 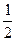 О2 (г) = СО2(г) ; ΔН3
О2 (г) = СО2(г) ; ΔН3
Закон Гесса дозволяє зв’язати теплові ефекти цих трьох процесів рівнянням:
ΔН1 = ΔН2 + ΔН3
Якщо два з цих теплових ефектів відомі, то легко розрахувати й третій.

Рис. 2. Схема процесів до закону Гесса.
З цього можна зробити висновок, що згідно із законом Гесса, незалежно від того, яким шляхом ми здобули карбон (ІV) оксид (СО2) – сумарний тепловий ефект буде однаковий (рис.2).
Користуючись законом Гесса, можна розрахувати теплові ефекти таких реакцій, які або важко реалізувати, або неможливо довести до кінця, або ж зовсім для нових процесів, які ще не відбувалися. Цей закон можна застосувати як до хімічних реакцій, так і до процесів розчинення, випаровування, кристалізації, адсорбції.
Читайте також:
- I. Особливості аферентних і еферентних шляхів вегетативного і соматичного відділів нервової системи
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- IV. Запасні речовини
- IV. Проблема антропогенних змін клімату або «парниковий ефект».
- IІI розділ. Аналіз стану маркетингового середовища підприємства
- L2.T4. Транспортування рідких, твердих та газоподібних речовин.
- L2.T4/1.Переміщення твердих речовин по території хімічного підприємства.
- Q6 розраховують тільки при нестаціонарному режимі
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- Абсолютна деформація ділянки бруса тільки від власної ваги визначається за формулою
- Абсорбція лікарської речовини в організмі.
- Аварії з викидом (загрозою викиду) сильнодіючих отруйних речовин на об'єктах економіки.
| <== попередня сторінка | | | наступна сторінка ==> |
| ЗАКОН ГЕССА | | | Наслідки закону Гесса |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |