
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Деякі властивості актиноїдів
 |
Досить важливою ознакою актиноїдів є їх радіоактивність. Всі актиноїди — хімічноактивні метали. На відміну від лантаноїдів, актиноїди легше утво-рюють сполуки, в яких вони мають ступені окиснення вищі, ніж +3.
Більшість елементів родини актиноїдів виявляють змінні ступені окиснення, але найстійкішими для них є такі: Торій +4 (може виявляти +2і +3), Протактиній +5, Уран +6, Нептуній +5, Плутоній +4, Америцій і всі інші +3.
Стійкість ступеня окиснення +4 для Торію зумовлена тим, що йон Th4+ має електронну конфігурацію Радону. Уран може виявляти ступінь окиснення +4, але найхарактернішим для нього є +6 (U4+ також має електронну конфігурацію Радону). Плутоній виявляє ступені окиснення від +3 до +7, найхарактернішим ступенем окиснення для нього є +4.
Оксиди актиноїдів утворюються внаслідок безпосередньої взаємодії їх з киснем. Для деяких актиноїдів відомо по кілька оксидів: Е2О3, ЕО2, Е2О5 і ЕО3. Для всіх актиноїдів оксиди Е2О3, ЕО2, Е2О5 — основні, а ЕО3 — амфотерні. Під час згоряння актиноїдів у кисні утворюються сполуки, що відповідають найстійкішим ступеням окиснення цих елементів, наприклад:
 |
Більшість оксидів актиноїдів зі ступенем окиснення +3 добре розчиняється у воді з утворенням основ. Основи Е(ОН)3 за силою подібні до гідроксидів РЗЕ, у воді розчиняються погано.
Торій утворює єдиний, основний оксид ThO2, який у воді не розчиняється, розчиняється під час нагрівання в концентрованій сульфатній кислоті або у суміші HNO3 і HF. ThO2 можна перевести у розчинний стан сплавлянням з гідрогенсульфатами лужних металів.
Під дією лугів на розчинні солі Торію утворюється білий осад гідроксиду торію Th(OH)4, який є основою середньої сили, у воді не розчиняється. Звичайна форма солей Торію містить його йон Th4+, але цей йон гідролізується в разі значень рН, вищих за 3.
Торій утворює численні комплексні сполуки. За наявності фторид-іонів можуть утворюватися комплексні сполуки, що містять йони [ThF(H2O)5]3+, [ThF2(H2O)4]2+. Добуто також солі з аніонними комплексними йонами: [Th(NO3)5]-, [Th(SO4)4(H2O)2]4– [ThF6]2–. Із водних розчинів солі Торію кристалізуються з 4—9 молекулами води: Th(NO3)4 · 4Н2О; Th(NO3)4 · 6Н2О; Th(SO4)2 · 9Н2О.
Уран під час нагрівання до 200 °С в атмосфері кисню або на повітрі утворює коричневий оксид UO2 та змішаний оксид U3O8 чорно-зеленого кольору.
Оксид урану(ІV) UO2 — основний, за властивостями подібний до ThO2. Йому відповідає основа U(OH)4.
Сполуки U(IV) в підкислених розчинах легко окиснюються з утворенням яскраво-жовтих солей уранілу.
Розкладанням деяких солей можна добути амфотерний оранжевий або жовтий оксид урану(VІ), який безпосередньо сполучається з водою й утворює кілька гідроксидів, найстійкішим є UO2(OH)2.
У водних розчинах Уран(VІ) утворює катіон UO —ураніл-іон. Відомо багато солей уранілу: сульфат і нітрат уранілу, які з водних розчинів кристалізуються у вигляді кристалогідратів: UO2(NO3)2 · 6Н2О, UO2SO4 · 3,5Н2О тощо.
—ураніл-іон. Відомо багато солей уранілу: сульфат і нітрат уранілу, які з водних розчинів кристалізуються у вигляді кристалогідратів: UO2(NO3)2 · 6Н2О, UO2SO4 · 3,5Н2О тощо.
Гідроксид уранілу UО2(ОН)2— амфотерна сполука. Під час взаємодії з кислотами UО2(ОН)2 утворює солі уранілу, у разі сплавляння з лугами —
+1 +1
уранати, Me2UO4, у водних розчинах утворюються діуранати Me2U2O7 .
Добуто два оксиди протактинію: чорний РаО2 і білий Ра2О5. Оксид прот-актинію(ІV) РаО2 ізоморфний з ThO2. Обидва оксиди основні. Легше утворюється Ра2О5, йому відповідає слабка малорозчинна основа Ра(ОН)5.
Під час нагрівання плутонію з киснем утворюється оксид РuО2 жовто-коричневого кольору.
Актиноїди добре сполучаються з галогенами з утворенням солей ЕГ3 і ЕГ4. Для Урану легко добути гексафторид UF6 — безбарвну кристалічну речовину, яка легко сублімується. У воді UF6 гідролізує з утворенням фториду уранілу UO2F2 і HF.
Тетрафторид урану UF4 добувають під дією HF на UO2. З хлором уран утворює зелений добре розчинний UC14. У разі надлишку хлору можна добути UC15 і UC16. UCl5 легко диспропорціонує на UC14 і UC12. Пента- і гексафториди урану малостійкі і не є солями.
У ряду електрохімічних потенціалів актиноїди розміщуються далеко попереду водню, тому вони взаємодіють з водою і кислотами.
Актиноїди легко розчиняються у кислотах-неокисниках з виділенням водню й утворенням відповідних солей з нижчими ступенями окиснення металу:
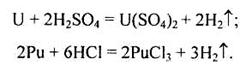 |
У високодисперсному стані Th, U, Pu активно поглинають водень, утворюючи нестехіометричні металоподібні сполуки, які за складом наближаються до EН3.
Під час нагрівання актиноїди здатні сполучатися з азотом, сіркою, вуглецем. З сіркою вони утворюють сульфіди складу E2S3 і ES2, з вуглецем — карбіди складу EC, EС2, а уран ще й U2C3.
Солі актиноїдів можна легко добути, розчиняючи відповідні гідроксиди у кислотах. Розчинними є нітрати, хлориди, сульфати актиноїдів. З водних розчинів ці солі кристалізуються у вигляді кристалогідратів: Pu2(SO4)3 · 7Н2О, Pu(NO3)3 · 6H2O.
Актиноїди, порівняно з лантаноїдами, більш здатні до утворення комплексних сполук. Так, Уран утворює комплексні нітрати, карбонати, сульфати, ацетати: (NH4)2[UO2(NO3)4], Na4[UО2(СО3)3], K4[UO2(SO4)3], Na[UO2(CH3COO)3].
Найбільше практичне значення мають торій, уран та плутоній. Торій застосовується в ядерній техніці. Він використовується як легувальний компонент у сплавах магнію з цинком, в нікелевих, кобальтових, магнієвих та інших сплавах. Оксид торію ТhO2 — найбільш вогнетривкий із стійких проти окиснення матеріалів. Цю сполуку використовують як каталізатор.
Для атомної енергетики дуже важливим є уран, особливо уран-235, вміст якого в природній руді становить тільки 0,72%. Уран-235 має великий поперечний переріз захоплення теплових нейтронів; поглинаючи нейтрони, він зазнає розпаду з виділенням величезної кількості енергії (внаслідок розпаду 1кг урану-235 виділяється 20 млн. кВт · год енергії). Джерелом енергії є також уран-233. З нукліда Урану-238 добувають нуклід Плутонію-239, який також може бути використаний в ядерних реакторах.
Відомо 15 ізотопів Плутонію з масовими числами від 232 до 246, більшість із них α-активні. Відокремити плутоній від урану можна хімічними методами, що значно простіше, ніж розділення ізотопів Урану. Тому Плутоній-239 приблизно вдвічі дешевший за Уран-235.
г) Положення в періодичній системі штучно добутих елементів.
Штучно добуті елементи – це, в основному, трансуранові елементи, які в періодичній таблиці розташовані після актиноїдів і продовжують заповнюватиVII період.
У 1940 p. було синтезовано перший трансурановий елемент—Нептуній. Процес відбувався під дією нейтронів на нуклід Урану 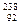 U. При цьому утворювався нестабільний β-радіоактивний нуклід Урану
U. При цьому утворювався нестабільний β-радіоактивний нуклід Урану 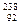 U,який самочинно
U,який самочинно
розпадався, випускаючи β-частинки і перетворюючись на новий, також радіоактивний елемент із протонним числом 93 — Нептуній Np. Останній, теж випускаючи β -частинки. перетворювався на елемент із протонним числом 94 — Плутоній Рu. Отже, дією нейтронів на радіоактивний Уран-238 можна добути два трансуранових елементи — Нептуній і Плутоній:
 |
У 50-х роках група вчених під керівництвом американського вченого Г. Сиборга синтезувала ізотопи трансуранових елементів із протонними числами 95—103. Так, 101-й елемент Менделевій Md добуто в 1955р. під час бомбардування атомів Ейнштейнію Es α-частинками:
 |
Російські вчені на чолі з академіком Г. М. Флеровим у 1964 р. синтезували нуклід 104 елемента і назвали його на честь видатного радянського фізика I.В.Курчатова Курчатовієм Ки. Нині цьому елементу присвоєно назву Резер-фордій.
Вихідним елементом для здійснення цієї ядерної реакції був радіоактивний нуклід Плутонію-242, бомбардуючими частинками — ядра атомів Неону:
 |
У 1970 p. в цій самій лабораторії було синтезовано 105-й елемент. Ядерна реакція відбувалася між нуклідом елемента Америцію-243 та ядрами атомів Неону:
 |
Для атомної енергетики дуже важливою сировиною є Уран, особливо нуклід Уран-235, вміст якого у природній урановій руді досягає 0,7 %. Захоплюючи нейтрони, ядра атомів Урану-235 розпадаються на два осколки з приблизно однаковими масами. Під час цього розпаду випускається кілька нейтронів — вторинні нейтрони, і виділяється величезна кількість енергії. Наприклад, під час розпаду ядер атомів 1г Урану-235 виділяється 75 · 109 Дж енергії. Розпад ядер атомів Урану-235 супроводжується випусканням більшого числа нейтронів, ніж їх затрачено:
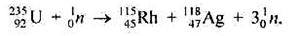 |
тому за наявності достатньої критичної маси 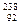 U реакція розпаду набуває ланцюгового характеру, тобто вторинні нейтрони можуть захоплюватися іншими ядрами Урану-235 і, в свою чергу, спричиняти їх розпад, що призведе до лавиноподібного збільшення числа окремих актів реакції. Для підтримання безперервного процесу розпаду маса шматка урану-235 повинна бути не меншою, ніж критична маса. В невеликому шматку урану ланцюгова реакція може обірватися, оскільки деякі вторинні нейтрони вилітатимуть за межі шматка урану, не встигнувши зіткнутися з ядром атома нукліда, здатного до розпаду.
U реакція розпаду набуває ланцюгового характеру, тобто вторинні нейтрони можуть захоплюватися іншими ядрами Урану-235 і, в свою чергу, спричиняти їх розпад, що призведе до лавиноподібного збільшення числа окремих актів реакції. Для підтримання безперервного процесу розпаду маса шматка урану-235 повинна бути не меншою, ніж критична маса. В невеликому шматку урану ланцюгова реакція може обірватися, оскільки деякі вторинні нейтрони вилітатимуть за межі шматка урану, не встигнувши зіткнутися з ядром атома нукліда, здатного до розпаду.
У разі неконтрольованого розпаду урану ланцюговий процес може набути характеру вибуху (на цьому грунтується дія атомних бомб). Щоб керувати реакцією розпаду урану, слід регулювати швидкість процесу зміною числа нейтронів. Для цього застосовують спеціальні стержні, що поглинають зайві нейтрони.
Джерелом ядерної енергії для промислових цілей служать плутоній-239 і нуклід урану-233, ядра атомів яких подібно до нукліда урану-235, захоплюючи нейтрони, розпадаються з виділенням величезної кількості енергії.
Джерелом енергії може служити також ядерний синтез, наприклад, синтез ядер атомів Гелію з ядер атомів Дейтерію і Тритію:
 Н +
Н + 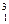 Н →
Н →  Н +
Н +  n
n
Внаслідок перебігу цієї реакції на кожен грам реакційної суміші виділяється 35 · 1010 Дж енергії, тобто майже в 5 разів більше, ніж під час розпаду 1г урану-235. Проте, щоб забезпечити перебіг цієї реакції, потрібно досягти температури понад І млн. градусів. Нині вдалося здійснити тільки некеровану термоядерну реакцію синтезу ядер атомів Гелію, яка призводить до вибуху величезної сили (на цьому ґрунтується дія водневих бомб). У багатьох країнах останнім часом ведуться дослідження з метою розробки керованого процесу термоядерного синтезу.
Велике значення як для науки, так і для виробництва мають радіоактивні ізотопи різних хімічних елементів, які широко застосовуються в медицині, сільському господарстві, промисловості. Особливо поширений метод «мічених» атомів, який Грунтується на тому, що хімічні властивості радіоактивних і стабільних нерадіоактивних ізотопів практично не відрізняються. Виявляють радіоактивні ізотопи за їх випромінюванням. Радіоактивність є своєрідною ознакою, яка дає змогу простежити за поведінкою елемента під час перебігу різних хімічних реакцій і його фізичних перетворень. Метод «мічених» атомів дав змогу розв'язати чимало проблем біології, фізіології, медицини тощо. За допомогою «мічених» атомів вивчені питання, які неможливо було розв'язати іншими методами.
Наприклад, досліджено обмін речовин у живому організмі. Зокрема виявлено, шо за порівняно невеликий період часу організм майже повністю оновлюється. Атоми, що входять до складу різних тканин організму, замінюються новими. Лише атоми Феруму, як показало вивчення ізотопного складу крові, є винятком із цього правила. Ферум входить до складу гемоглобіну крові. В разі введення в їжу радіоактивних атомів Fe-59 виявлено, що вони майже не надходять у кров, і тільки в тому випадку, коли запаси Феруму в організмі вичерпані, Ферум починає засвоюватись організмом.
Радіоактивні ізотопи застосовуються також у медицині для встановлення діагнозу, лікування деяких хвороб.
У техніці радіоактивні ізотопи широко використовуються для дослідження дифузії металів, процесів, що відбуваються в доменних печах. За γ-випромі-нюванням радіоактивних речовин досліджують структуру металевих виробів з метою виявлення в них дефектів (мікротріщин, порожнин тощо).
Широко застосовується метод «мічених» атомів в агротехніці. Наприклад, щоб виявити, яке з фосфорних добрив краще засвоюється рослинами, в різні добрива добавляють радіоактивний фосфор-32. Досліджуючи пізніше ці рослини на радіоактивність, можна визначити кількість засвоєного ними Фосфору з різних добрив.
У сільському господарстві радіоактивні ізотопи використовують для опромінення насіння рослин. Обробка насіння невеликими дозами γ -проміння сприяє підвищенню врожайності. Підвищені дози радіації викликають різні мутації у рослин і мікроорганізмів. В окремих випадках це сприяє появі мутантів з новими цінними властивостями (радіоселекція). Так були виведені деякі нові сорти пшениці, квасолі та інших культур, а також одержані високопродуктивні штами мікроорганізмів, що застосовуються у виробництві антибіотиків. γ-Випромінювання радіоактивних ізотопів використовують також для боротьби з шкідниками сільського господарства.
Завдання для самоперевірки:
1. Задача. Елемент астат (ізотон  Аt) був отриманий у результаті опромінення ізотопу вісмуту
Аt) був отриманий у результаті опромінення ізотопу вісмуту  Ві α– частинками (ядрами атомів гелію). Напишіть рівняння ядерної реакції у повній і скороченій формі.
Ві α– частинками (ядрами атомів гелію). Напишіть рівняння ядерної реакції у повній і скороченій формі.
2. Визначте число протонів і нейтронів у ядрі атома технецію (ізотоп з атомною масою 99) і у ядрі атома радію (ізотоп з атомною масою 226) (стор. 31. Г.П.Хомченко).
3. Задача. Мідь має два ізотопи 63Сu і 65Сu. Молярні частинки їх у природній міді становить 73 і 27% відповідно. Визначте середню відносну атомну масу міді (стор. 29 Г.П.Хомченко).
Читайте також:
- Агітація за і проти та деякі особливості її техніки.
- Аеродинамічні властивості колісної машини
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- Атрибутивні ознаки і властивості культури
- Білки, властивості, роль в життєдіяльності організмів.
- Біосфера Землі, її характерні властивості
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Будова і властивості аналізаторів
- Векторний добуток і його властивості.
- Види і властивості радіоактивних випромінювань
- Визначення добутку на множині цілих невід’ємних чисел, його існування та єдиність. Операція множення та її основні властивості (закони).
| <== попередня сторінка | | | наступна сторінка ==> |
| Деякі властивості лантаноїдів | | | Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |