
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Деякі властивості лантаноїдів
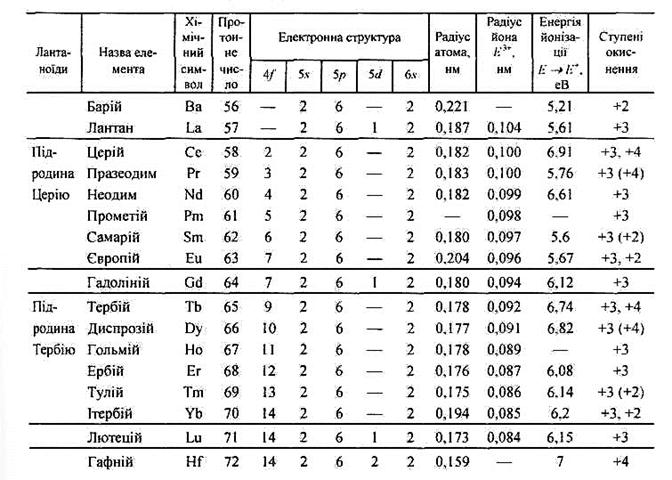
Добування і розділення лантаноїдів пов'язане з великими труднощами. Ці елементи трапляються завжди разом, і їх сполуки дуже подібні за властивостями. Раніше для їх розділення застосовували фракційну кристалізацію, що грунтувалась на дещо різній розчинності їхніх солей. Щоб добути чисті елементи, доводилось проводити тисячі операцій з виділення кристалів. Нині сполуки РЗЕ розділяють, пропускаючи розчин солей лантаноїдів крізь колонку, заповнену катіонітом. Цей метод грунтується на різній здатності йонів РЗЕ до комплексоутворення, зумовленій відмінністю їхніх йонних радіусів. Зі зменшенням радіусів йонів зростає стійкість комплексів R(Ш) з Н2О. Тому катіоніт гірше адсорбує гідратовані йони важких лантаноїдів. Ступінь розділення можна підвищити добавлянням у розчин комплексоутворювачів. зокрема органічних кислот.
Вилучити церій із суміші найлегше, оскільки, на відміну від інших РЗЕ, сполуки Церію(ІV), які можна добути окисненням сполук Церію(Ш) персульфатом,— стійкі.
У вільному стані лантаноїди добувають металотермічним відновленням фторидів або хлоридів РЗЕ (відновник Са або Mg).
Легкі лантаноїди можна добути також електролізом розплаву EС13 з добавлянням NaCl, KC1 або СаС12, важкі лантаноїди — електролізом розплаву EС13 з рідким катодом із цинку або кадмію.
Прості речовини лантаноїди — тугоплавкі сріблясто-білі метали (Рr і Nd злегка жовтуваті). Від церію до лютецію в зміні густини, температур плавлення і кипіння виявляється внутрішня періодичність. Лантаноїди мають невисоку твердість, здатні проводити теплоту й електричний струм.
Лантаноїди дуже активні метали. За хімічною активністю вони поступаються лише лужним і лужноземельним металам. У вологому повітрі вони швидко тьмяніють, вкриваючись плівкою оксиду E2О3 (церій — СеО2). У разі нагрівання до 200—400 °С самозаймаються на повітрі і згоряють з утворенням суміші оксидів і нітридів. Церій у порошкоподібному стані здатний самозайматися на повітрі за звичайних умов (пірофорний).
Стандартні електродні потенціали лантаноїдів дорівнюють -2,3...-2,5 В, тому вони активно витісняють водень із води і кислот. Лантаноїди не розчиняються у лугах. У розчинах фторидної та ортофосфатної кислот вони стійкі внаслідок утворення захисної плівки з нерозчинних солей.
Лантаноїди здатні взаємодіяти з галогенами, а під час нагрівання — з азотом, сіркою, вуглецем, силіцієм, фосфором, воднем. З більшістю металів вони утворюють сплави, які часто виявляють властивості металоїдів (Се3А1, CeMg, CeCu2, PrAl тощо).
Лантаноїди з воднем утворюють гідриди LnH2 і LnH3. Нітриди лантаноїдів добувають нагріванням відповідних металів з азотом. Вони мають сольовий характер, легко розкладаються водою з утворенням Ln(OH)3 і NH3.
За високої температури добуто також солеподібні карбіди LnC2 і Ln2C3. Під час взаємодії з водою перші утворюють ацетилен з домішками водню, другі — суміш різних вуглеводнів, у тім числі і рідких.
Оксиди Ln2O3 — тверді, стійкі, тугоплавкі сполуки, належать до основних оксидів. Оксиди легких лантаноїдів взаємодіють з водою з утворенням відповідних основ Ln(OH)3. Оксиди важких лантаноїдів з водою практично не взаємодіють. Оксиди Ln2O3 добре розчиняються в кислотах з утворенням солей. Інтенсивність взаємодії Ln2O3 з кислотами від Се2О3 до Lu2O3 зменшується. Після сильного прожарювання оксиди лантаноїдів втрачають хімічну активність; з лугами не взаємодіють.
Гідроксиди РЗЕ погано розчиняються у воді. їх можна добути за реакцією обміну.
Відповідно до зменшення йонних радіусів у ряду Ce3+—Lu3+ дещо послаблюється основний характер гідроксидів, зменшуються їхня термостійкість і розчинність. Отже, Lu(OH)3, як і Sc(OH)3, виявляє амфотерність.
Усі рідкісноземельні метали енергійно взаємодіють з галогенами з утворенням солей ЬпГ3, з сіркою і селеном взаємодіють під час нагрівання.
Як в оксидів, так і в галогенідів Ln(ІІІ) переважає сольово-основна функція. Тому вони легше утворюють катіонні комплекси (для лантаноїдів характерні координаційні числа 8 і 9).
Через підвищену здатність до утворення катіонних комплексів більшість солей лантаноїдів утворює кристалогідрати La(C1O4)3 · 9Н2О; Ce2(SO4)3 · 12Н2О,
Рr2(С2О4)3·10Н2О. Отже, катіони Ln3+ здатні утворювати досить міцні аква-комплекси складу [Ln(Н2О)n]3+, а також амінокомплекси, однак зв'язок Ln3+ ← NH3 слабкіший, ніж Ln3+ ←ОН2.
Солі Ln(III) майже не гідролізують, оскільки Ln(OH)3 — досить сильні основи.
Малорозчинними є фториди, фосфати, карбонати, оксалати РЗЕ.
Лантаноїди застосовуються як добавки до різних сплавів.
Із сталі, що містить 6 % Се, виготовляють хірургічні інструменти, з магнієвих сплавів, що містять добавки Ln,— деталі літаків і ракет. Оксиди лантаноїдів (наприклад, СеО2) застосовують як каталізатори.
Завдяки високій температурі плавлення оксиди, сульфіди, нітриди, карбіди лантаноїдів використовують для виготовлення вогнетривкої кераміки.
Лантаноїди, зокрема Nd, входять до складу багатьох лазерних матеріалів, радіоактивні ізотопи РЗЕ, наприклад Рm, застосовують у виробництві мініатюрних електробатарейок, І70Тm, який випромінює м'які γ-промені,— у портативних γ -просвітлювачах.
в) Положення в періодичній системі актиноїдів:
Актиноїди, подібно до лантаноїдів, об'єднують родину 14f-елементів, подібних за своїми властивостями: Торій Th, Протактиній Ра, Уран U, Нептуній Np, Плутоній Рu, Америцій Am, Кюрій Cm, Берклій Вk, Каліфорній Cf, Ейнштейній Es, Фермій Fm, Менделевій Md, Нобелій No, Лоуренсій Lr.
Уран, Торій, Протактиній, Нептуній і Плутоній трапляються у природі (Ра в дуже малих кількостях, Np і Pu — в мізерних). Всі інші актиноїди в природі не існують, вони добуті штучно за допомогою різних ядерних перетворень.
Всі актиноїди радіоактивні. У міру збільшення протонного числа елементів енергія зв'язку 5f-електронів з ядром атома поступово підвищується, а енергія зв'язку 6d-електронів—знижується. Починаючи з Протактинію, вона набуває сталого значення і за величиною менша, ніж енергія зв'язку 5 f-електронів.
Оскільки в атомах елементів Th—Cm 6d- і 5 f-стани електронів енергетично близькі, ці актиноїди виступають як f- і як d -елементи і виявляють змінні ступені окиснення.
 У міру заповнення 5f-підрівня електронні конфігурації атомів стабілізуються і перехід 5 f -електронів в 6d-стан стає все менш енергетично вигідним. Тому елементи від Берклію до Лоуренсію поводять себе як типові f -елементи, за властивостями вони дуже подібні до лантаноїдів. Отже, у ряду актиноїдів спочатку спостерігається підвищення (Th—Pu), а потім поступове зниження (Pu—Bk) величини максимального ступеня окиснення:
У міру заповнення 5f-підрівня електронні конфігурації атомів стабілізуються і перехід 5 f -електронів в 6d-стан стає все менш енергетично вигідним. Тому елементи від Берклію до Лоуренсію поводять себе як типові f -елементи, за властивостями вони дуже подібні до лантаноїдів. Отже, у ряду актиноїдів спочатку спостерігається підвищення (Th—Pu), а потім поступове зниження (Pu—Bk) величини максимального ступеня окиснення:
Вміст у земній корі Урану становить 3 · 10-4,Торію 8 ·10 4 %. Торій і Уран належать до розсіяних елементів, Протактиній — до рідкісних, його у земній корі міститься всього 8 ·10-11 %.
Уран завжди міститься в гранітах (близько 0,004 %), трапляється у вигляді мінералів ураніту, карнотиту.
Торій трапляється у мінералах торіаніті ТhO2, ториті ThSiO4, монациті тощо.
У природі існує кілька нуклідів Урану: 238U (99,2739 %), 235U (0,7204 %) і 234U(0,0057 %). 238U має найбільший період піврозпаду (Т1/2= 4,51 · 109 років).
З актиноїдів найбільше практичне застосування мають Уран, Торій і в
меншій мірі Плутоній.
Для добування урану насамперед збагачують руду. Добутий концентрат, що містить оксиди урану, обробляють сульфатною кислотою й оксидом ман-rany(IV). Сульфат уранілу UO2SO4, що утворюється, вилучають з розчину екстракцією. Іноді з руди добувають сполуку UO2(NO2)2, внаслідок термічного розкладання якої утворюється суміш оксидів UO2 і U3O8, які відновлюють воднем.
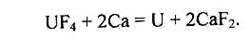 Для добування металічного урану на UO2 за температури 500°С діють фтороводнем; UF4, що при цьому утворюється, відновлюють кальцієм або магнієм:
Для добування металічного урану на UO2 за температури 500°С діють фтороводнем; UF4, що при цьому утворюється, відновлюють кальцієм або магнієм:
Світовий видобуток урану досягає 100 тис. т на рік. Аналогічно добувають і торій.
Плутоній утворюється в ядерних реакторах з 238U внаслідок захоплення ядрами його атомів швидких нейтронів.
З актиноїдів найкраще вивчено Торій, Протактиній, Уран, Нептуній і Плутоній.
Прості речовини актиноїди — це сріблясто-білі метали, мають високу густину (11—20 г/см3), відносно високі температури плавлення (640—2000 °С). Всі вони м'які, пластичні, деякі з них, зокрема уран, можна різати ножем. З нагрітого торію, який за твердістю подібний до м'якої сталі, можна виковувати листи, витягувати дріт. Деякі властивості елементів родини актиноїдів наведено в табл.2.2.2.
Радіуси йонів актиноїдів, як і йонів лантаноїдів, закономірно зменшуються зі збільшенням протонного числа елементів. Ця тенденція зумовлена заповненням електронами 5f-підрівня. Йони актиноїдів, як і йони лантаноїдів, парамагнітні, величина магнітної сприйнятливості для обох типів йонів змінюється однаково залежно від кількості f- електронів. Це дає підставу зробити висновок про подібність властивостей антаноїдів і актиноїдів.
Таблиця 2.2.2.
Читайте також:
- Агітація за і проти та деякі особливості її техніки.
- Аеродинамічні властивості колісної машини
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- Атрибутивні ознаки і властивості культури
- Білки, властивості, роль в життєдіяльності організмів.
- Біосфера Землі, її характерні властивості
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Будова і властивості аналізаторів
- Векторний добуток і його властивості.
- Види і властивості радіоактивних випромінювань
- Визначення добутку на множині цілих невід’ємних чисел, його існування та єдиність. Операція множення та її основні властивості (закони).
| <== попередня сторінка | | | наступна сторінка ==> |
| Тема 2.2. Періодичний закон і періодична система хімічних елементів Д.І.Менделеєва | | | Деякі властивості актиноїдів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |