
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Горіння металів
На здатність металу до горіння впливають властивості як самих металів, так і властивості їх оксидів. Особливо великий вплив мають такі фактори: активність металу, захисні властивості оксидної плівки, що утворюється на поверхні металу, температура плавлення та кипіння металу та оксиду металу. За характером горіння розрізняють леткі та нелеткі метали.
Горіння летких металів (Li, Na, K, Mg, Ca). Леткі метали – це метали, які під час горіння нагріваються вище температури кипіння, тобто метали з низькими температурами кипіння. У більшості випадків температура плавлення оксидів таких металів вища, ніж температура кипіння оксиду. В такому випадку на поверхні рідкого металу знаходиться тверда оксидна плівка. Пари металу проходять крізь оксидну плівку і в повітрі реагують з киснем. Зона горіння встановлюється поблизу поверхні металу. Більша частина тепла передається металу, і він починає кипіти. Кипіння викликає руйнування твердої оксидної плівки. Інтенсивність горіння збільшується. Поступово температура горіння збільшується і починає випаровуватися оксид, що знаходиться на поверхні металу. Це, в свою чергу, призводить до ще більшого зростання інтенсивності горіння. Пари оксиду, що виходять з зони горіння, – конденсуються та утворюють маленькі частки – дим. Утворення щільного білого диму є ознакою горіння летких металів.
Горіння нелетких металів (Ti, Be). Нелеткі метали – це такі метали, температура кипіння яких перевищує температуру плавлення оксидів, що утворюються на поверхні металу. При горінні таких металів їх оксиди знаходяться на поверхні металу в рідкому стані. Тиск пари над такими металами невеликий. Тому великі частки таких металів не горять. Але нелеткі метали горять у порошкоподібному стані, у вигляді тонкої стружки або аерозолю. Вони горять без утворення щільного білого диму.
Деякі метали можуть самозайматися за звичайних умов. В компактному стані самозаймаються рубідій і цезій. У подрібненому стані можуть займатися не тількі ативні метали (лужні та лужно-земельні), але і метали середьої активності (цинкова, магнієва, алюмінієва та залізна пудра). Метали, здатні самозайматися при контакті з киснем повітря за звичайних умов, називають пірофорними.
Приклад 40.
Який об'єм газу (н.у.) вилучиться при реакції 10 г міді з надлишком концентрованого розчину азотної кислоти?
Розв'язання.
1. При реакції концентрованої азотної кислоти з неактивними металами вилучається оксид азоту (ІV):
Cu + 4 HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
З рівняння реакції видно, що при реакції 1 молю міді вилучається 2 моля, або 2´22.4=44.8 л диоксиду азоту.
2. Визначимо кількість міді: n=m/A=10/63.5=0,16 моль.
3. Визначимо об'єм диоксиду азоту: V=0,16´44.8=7.1 л.
Приклад 41.
Записати рівняння реакцій за допомогою яких можна здійснити такі перетворення:
Na®Na2O®NaOH®NaBr®NaNO3.
Для кожної речовини дати назву, вказати до якого класу неорганічних речовин відноситься кожна сполука. Для окисно-відновних реакцій написати електроні рівняння, для іонообмінних – іонні рівняння.
Розв'язання.
1. 4Na + O2®2Na2O,
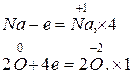
2. Na2O + H2O ® 2NaOH,
3. NaOH + HBr ® NaBr + H2O,
в іоному вигляді: Na++ OH– + H+ +Br – ® Na+ +Br – + H2O
в скороченому іоному вигляді: H+ + OH– ® H2O.
4. NaBr + AgNO3 ® NaNO3 + AgBr¯,
в іоному вигляді: Na++ Br – + Ag+ + NO3– ® Na+ + NO3– + AgBr¯,
в скороченому іоному вигляді: Ag+ + Br –® AgBr¯.
Назви і класи сполук: Na – натрій, проста речовина – метал; Na2O – оксид натрію, клас – оксиди; NaOH – гідроксид натрію, клас – основи; NaBr – бромід натрію, клас – сіль; NaNO3 – нітрат натрію, клас – сіль.
Запитання для самоконтролю
1. Як змінюються металічні властивості в групах і періодах періодичної системи елементів?
2. Який елемент проявляє найбільші металічні властивості?
3. Які метали відносяться до лужних, лужноземельних, легких і важких конструкційних?
4. Які сполуки називаються гідридами?
5. Які метали відносяться до амфотерних?
6. Які існують методи добування металів?
7. Які метали найбільш поширені у земній корі?
8. Сформулюйте правила, які визначають можливість реакції металів з водою, кислотами та лугами?
9. Для гасіння яких металів не можна використовувати воду? Чому?
10. Які фактори впливають на горіння металів?
Тема 14. Хімія неметалів
Читайте також:
- Анізотропія властивостей металів.
- Атомно-кристалічна структура металів
- Будова атомів металів.
- БУДОВА, ВЛАСТИВОСТІ МЕТАЛІВ ТА СПОСОБИ ЇХ ВИЗНАЧЕННЯ
- Бухгалтерський облік операцій з купівлі-продажу іноземної валюти та банківських металів на міжбанківському валютному ринку
- Взаємодія металів з простими та складними речовинами.
- Взаємодія металів з розчинами солей.
- Вивезення валюти України, іноземної валюти та банківських металів
- Визначення важких металів
- Виробництво чорних металів
- Відновлення металів може проводитись різними методами, які зручно об'єднати в такі групи: пірометалургійні, гідрометалургійні та електрометалургійні.
- Відносна електронегативність деяких неметалів
| <== попередня сторінка | | | наступна сторінка ==> |
| Загальні властивості металів. | | | Загальна характеристика неметалів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |