
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Взаємодія металів з простими та складними речовинами.
Властивості елементів підгрупи бору
| Властивості | Ве | Mg | Ca | Sr | Ba |
| 1. Порядковий номер | |||||
| 2. Валентні електрони | 2s22p1 | 3s23p1 | 4s24p1 | 5s25p1 | 6s26p1 |
| 3. Енергія іонізації атома R→R3+, еВ | 71,35 | 53,20 | 57,20 | 52,69 | 56,31 |
| 4. Відносна елек-тронегативність | 2,01 | 1,47 | 1,82 | 1,49 | 1,44 |
| 5. Ступінь окис-нення у сполуках | +3, –3 | +3 | +3 | +3 | +2, +3 |
| 6. Радіус атома, нм | 0,091 | 0,143 | 0,139 | 0,116 | 0,171 |
Усі елементи підгрупи належать до р-елементів атоми на зовнішньому енергетичному рівні мають по три електрони (s2 1p ), чим пояснюється подібність ряду властивостей. У хімічних сполуках ці елементи виявляють ступінь окиснення, що дорівнює +3 (бор також і —3), хоча для талію стійкішим є ступінь окиснення +1.
Металічні властивості елементів підгрупи бору виражено значно слабше, ніж елементів підгрупи берилію. Так, елемент бор, який у періоді розташований між берилієм та карбоном, належить до елементів-неметалів. Він має найбільшу енергію іонізації атома. Всередині підгрупи зі зростанням заряду ядра енергія іонізації атомів зменшується і металічні властивості елементів посилюються. Алюміній — вже метал, але не типовий. Його гідроксид має амфотерні властивості. У талію металічні властивості виражено сильніше, а в ступені окиснення +1 він близький до елементів-металів підгрупи літію.
Всі елементи підгрупи бору утворюють оксиди типу R2O3. їм відповідають гідроксиди складу R(OH)3. Крім бору, у водних розчинах вони можуть перебувати у вигляді гідратованих іонів R3+. Бор — кислотоутворюючий елемент.
Із металів головної підгрупи III групи найбільше значення має алюміній.
Атомиметалів порівняно легко віддають валентні електрони і перетворюються на позитивно заряджені іони, Тому металиє відновниками. В цьому, власне, і полягає їх головна і найзагальніша хімічна властивість.
Очевидно, метали як відновники вступатимуть в реакції з різними окисниками, серед яких можуть бути прості речовини кислоти, солі менш активних металів та деякі інші сполуки, Сполуки металів з галогенами називаються галогенідами, із сульфуром — сульфідами, з нітрогеном — нітридами, з фосфором — фосфідами, з карбоном — карбідами, з силіцієм — силіцидами, з бором — боридами, з гідрогеном — гідридами і т.д. Багато з цих сполук знайшли важливе застосування в новій техніці. Наприклад, бориди металів використовуються в радіоелектроніці, а також у ядерній техніці як матеріали для регулювання нейтронного випромі-нювання та захисту від нього.
 Взаємодія металів з кислотами —окисно-відновний процес. Окисником є іон гідрогену, який приймає електрон від атома металу:
Взаємодія металів з кислотами —окисно-відновний процес. Окисником є іон гідрогену, який приймає електрон від атома металу:
Взаємодію металів з водними розчинами солей менш активних металів можна показати на прикладі:
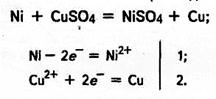 |
У цьому випадку відбувається відщеплення електронів від атомів більш активного металу (Ni) і приєднання Тх іонами менш активного (Сu2+).
 Активні метали взаємодіють з водою, яка виступає в ролі окисника. Наприклад:
Активні метали взаємодіють з водою, яка виступає в ролі окисника. Наприклад:
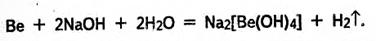 Метали, гідроксиди яких амфотерні, як правило, взаємодіють з розчинами і кислот, і лугів. Наприклад:
Метали, гідроксиди яких амфотерні, як правило, взаємодіють з розчинами і кислот, і лугів. Наприклад:
Отже, характер взаємодії металів з неметалами, кислотами, розчинами солей менш активних металів, водою і лугами підтверджує їх головну хімічну властивість — відновну здатність.
Метали можуть утворювати хімічні сполуки між собою. Вони мають загальну назву — інтерметалічні сполуки, або інтерметаліди. Прикладом можуть бути сполуки деяких металів із стибієм: Na2Sb, СазSb2, NiSb, Ni4Sb, FeSbx (х = 0,72 — 0,92). У них найчастіше не витримуються ступені окиснення, характерні з сполуках з неметалами. Звичайно це бертоліди.
Хімічний зв'язок в інтерметалідах переважно металічний. За зовнішнім виглядом вони схожі на метали. Твердість інтер-металідів, як'правило, вища, а пластичність набагато нижча, ніж у металів, що їх утворюють. Багато інтерметалідів знайшли практичне застосування. Наприклад, стибій—алюміній AlSb, стибій-індій InSb та інші широко використовуються як напівпровідники.
Завдання для самоперевірки:
1. Мідна руда містить малахіт CuCO3∙Cu(OH)2 і азурит 2 Cu CO3∙ Cu(OH)2. Яку масу міді можна отримати з руди масою 5т, якщо масова частка малахіту становить 8,0%, азуриту 3,6%? Визначте масову частку міді в руді.
2. Яку масу свинцю можна отримати проводячи електроліз водного розчину плюмбуму (ІІ) нітрату масою 60г? Масова частка солі в розчині становить 15%. Якщо об′єм газу, виміряний за н.у., виділиться під час електролізу?
3. Методом електронного балансу доберіть коефіцієнти в схемах реакцій взаємодії металів з кислотами:
а) Al+HCl→
б) Zn+H2SO4(конц) →
в) Ca+ H2SO4(конц) →… +H2S…;
г) Ві+НNO3→ Ві(NO3)2+ NO+ H2O
Читайте також:
- Активно взаємодіяти з навколишнім світом
- Анізотропія властивостей металів.
- Атомно-кристалічна структура металів
- Багатоманітність і взаємодія культур
- В Україні акції можуть бути іменними та на пред'явника, привілейованими і простими.
- Взаємодія
- Взаємодія +Це єдність В. і в-ця.
- Взаємодія алельних генів
- Взаємодія важелів. Оцінка сукупного ризику, зв'язаного з підприємством.
- Взаємодія гамма квантів з речовиною
- Взаємодія гамма-квантів з речовиною
- Взаємодія ДСМК з іншими аварійно-рятувальними службами.
| <== попередня сторінка | | | наступна сторінка ==> |
| Властивості елементів підгрупи берилію | | | Загальний огляд металічних елементів побічних підгруп. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |