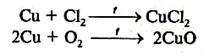МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Загальний огляд металічних елементів побічних підгруп.
Тема 5.2. Метали
Лекція № 15
1. Загальний огляд металічних елементів побічних підгруп.
2. Мідь, Цинк, Тиатан, Хром, Залізо, Нікол, Платина.
Атоми металів побічних підгруп мають, як правило, у зовнішньому електронному шарі 1—2 електрони, а в передостанньому — більше восьми (s2p6d1…10). Значення потенціалів (іонізації атомів цих металів вищі, а їх активність із збільшенням протонного числа зменшується. Так, найактивнішим металом побічної підгрупи І групи є мідь, найменш активним — золото.
В атомах перехідних металів електрони заповнюють внутрішні енергетичні рівні, тому утримуються ядром сильніше, ніж електрони, розміщені на останньому енергетичному рівні. Цим і пояснюється той факт, що радіуси атомів елементів побічних підгруп менші, ніж передбачалися за аналогією з атомами металів головних підгруп за нормального заповнення електронних шарів. Тому й виникає різка зміна активностей металів головних і побічних підгруп.
У металів головних підгруп заповнюється зовнішній рівень – s– та p –орбіталі.
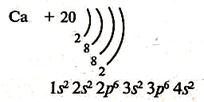 | ||||
 | ||||
 |
У металів же побічних підгруп заповнюється рівень, який передує зовнішньому, — d-орбіталь.
 | 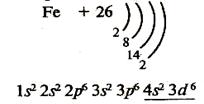 | ||
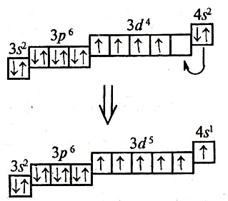
Якщо на попередньому зовнішньому рівні d-орбіталі знаходяться 4 (до половинного заповнення не вистачає одного) та 9 (до повного заповнення не вистачає одного) електронів, то із зовнішнього рівня s-орбіталі один електрон переходить на рівень, який передує зовнішньому.
 | |||||
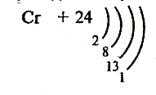 | |||||
 |
Порівняємо будову та властивості металів головної та побічної підгруп на прикладі К та Сu.
 | |||
 | |||
Слабка здатність віддавати електрони.
Відновні властивості слабкіші.
Заповнюється рівень, який передує зовнішньому, d-орбіталь, у Купруму відбу-вається «провал»зовнішніх електронів.
Ступінь окиснення +1, +2.
Світло-рожевий метал, тягучий, в'язкий, легко прокатується, висока температура плавлення, добре проводить електричний струм.
Реагує з концентрованою сірчаною та азотною кислотами. |
Більш сильна здатність віддавати
електрони.
Більш сильні відновні властивості.
Заповнюється зовнішній рівень,
s–орбіталь.
Ступінь окиснення +1.
Сріблясто-білий метал, легкий, м'який,
низька температура плавлення.
 |
Бурно реагує з водою, із кислотами.
Читайте також:
- II. Відкриття і подолання схоластичного світогляду
- II. За зміною ступенів окиснення елементів, які входять до складу реагуючих речовин
- Аналіз службового призначення деталей та конструктивних елементів обладнання харчових виробництві, визначення технічних вимог і норм точності при їх виготовленні
- Аналітичний огляд
- Аналітичний огляд використання вторинної сировини і відходів
- Будова атомів хімічних елементів.
- Будова нагрівальних елементів
- Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук.
- Взаємозв’язок елементів управління
- Виберіть 2 положення, які треба добавити у визначення елементів наукової проблеми.
- Вивчення структури та зв”язку структурних зрушень елементів.
- Види світогляду: міфологічний, релігійний та філософський (натуралістична, об’єктивно-ідеалістична, субєктивно-ідеалістичні і матеріалістичні моделі).
| <== попередня сторінка | | | наступна сторінка ==> |
| Взаємодія металів з простими та складними речовинами. | | | Мідь, Цинк, Титан, Хром, Залізо, Нікол, Платина. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |