
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Кислоти
Кислотаминазивають сполуки, до складу яких входять атоми Гідрогену, здатні заміщуватися атомами металу.
Згідно з теорією електролітичної дисоціації кислоти – це електроліти, які під час дисоціації утворюють тільки один вид позитивно заряджених іонів - катіони Гідрогену.
Номенклатура. Назву кислоти можна визначити за латинською назвою кислотного залишку. До основи назви кислотного залишку додають закінчення: для безоксигенових кислот -ідначи -идна; для оксигеновмісних кислот -ітна чи -итна (кислотоутворювальний елемент проміжного ступеня окиснення); -атна (кислотоутворювальний елемент вищого ступеня окиснення). Наприклад: HCl – хлоридна, H2S – сульфідна, HNO2 – нітритна, HNO3 – нітратна.
Кислоти класифікують за різними критеріями (рис. 2).
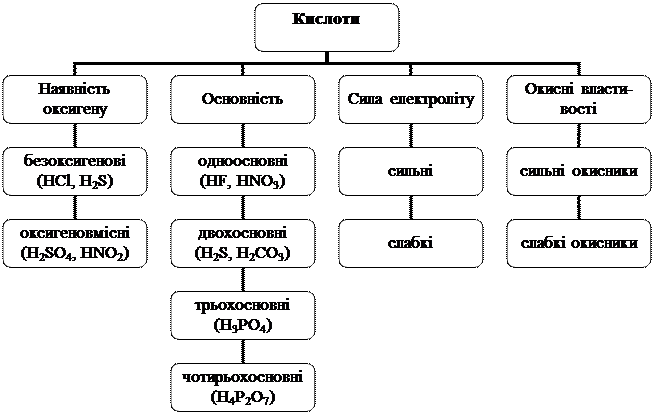
Рис. 2. Схема класифікації кислот
Оксигеновмісні кислоти є гідратами (продуктами сполучення з водою) оксидів неметалів, а також оксидів деяких металів вищих ступенів окиснення (+5, +6, +7). Наприклад, карбонатна кислота Н2СО3 - продукт сполучення з водою СО2, сульфатна кислота H2SО4 - SO3, хроматна кислота Н2СrО4 - СrО3.
Число атомів Гідрогену кислоти, здатних заміщуватися атомами металу з утворенням солі, визначає основність кислоти. Так, НСl, НВr, HNO3, СН3СООН - одноосновні кислоти; H2S, H2SO4, Н2СO3, Н3РO3 — двохосновні; Н3РО4, H3AsO4 - трьохосновні.
Негативні іони, які утворюються в результаті відриву від молекули кислоти одного або кількох іонів Гідрогену, називаються кислотними залишками.Значення негативного заряду іона кислотного залишку визначається числом іонів Гідрогену, що відірвалися.
Наявність атомів Гідрогену в кислотних залишках позначається словом гідроген-, якщо треба – з відповідним префіксом. Наприклад, HSO4- – гідрогенсульфат, H2PO4- – дигідрогенфосфат.
Фізичні властивості. Кислоти можуть бути твердими (боратна Н3ВО3, силікатна H2SiО3) або рідкими (сульфатна H2SO4, нітратна HNО3). Більшість із них добре розчиняються у воді. Кислотами є також водні розчини газоподібних водневих сполук деяких неметалів (НСl, НВr, H2S, HCN, HCNS). У молекулах кислот атоми Гідрогену зв'язані з кислотними залишками ковалентним полярним зв'язком.
Хімічні властивості.
1. Кислоти у водних розчинах дисоціюють на іони, сильні кислоти - повністю, слабкі - мало:
НСl« Н+ + Сl-;
H2SO4 « Н+ + HSO4-;
Н3РО4 « Н+ + Н2РO4-.
Кислоти мають деякі загальні властивості, обумовлені наявністю іонів Гідрогену Н+. Так, вони змінюють забарвлення багатьох індикаторів (табл. 4).
Таблиця 4. Інтервали переходу індикаторів
| Індикатор | Значення рН | ||||
| 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 | |||||
| Лакмус | Червоний | Інтервал переходу | Синій | ||
| Фенолфталеїн | Безбарвний | Інтервал переходу | Малиновий | ||
| Метиловий оранжевий | Рожевий | Інтервал переходу | Жовтий | ||
2. Кислоти реагують з основами. Взаємодія кислоти з основою, в результаті якої утворюється сіль і вода, називаєтьсяреакцією нейтралізації:
NaOH + HCl ® NaCl + H2O.
Реакції між нерозчинними основами та амфотерними гідроксидами й кислотою теж є реакціями нейтралізації. За цих умов амфотерний гідроксид виявляє основні властивості.
Якщо в реакції нейтралізації беруть участь багатокислотні основи або багатоосновні кислоти, можуть утворюватися середні, кислі та основні солі:
Fе(ОН)3 + НС1 ® Fe(OH)2Cl + H2O;
Fe(OH)3 + 3HCl ® FeCl3 + 3Н2О;
NaOH + H2SO4 ® NaHSO4 + H2O.
3. Кислоти взаємодіють з основними та амфотерними оксидами з утворенням солі та води:
СаО + 2HNO3 ® Ca(NO3)2 + Н2О;
Fе2O3 + 6НNО3 ® 2Fe(NO3)3 + 3Н3O.
4. Кислоти реагують з металами. У результаті реакції утворюється сіль і виділяється водень:
Zn + Н2SO4(розв) ® ZnSO4 + H2.
Метали, які в ряді стандартних електродних потенціалів знаходяться ліворуч від водню, витісняють його з кислот, а розташовані праворуч (Cu, Hg, Ag, Аu, Pt) — не витісняють.
5. Кислоти взаємодіють із солями. При цьому можуть утворюватися такі сполуки:
а) нова кислота та сіль (середня або кисла):
2NaCl(cyx) + Н2SO4(конц) ® Na2SO4 + 2НС1;
2NaNO3(cyx) + Н2SO4(конц) ® Na2SO4 + 2HNO3;
FeS + 2HCl ® FeCl2 + H2S.
Якщо кислота, яка утворюється, є нестійка, вона може розкладатися з утворенням кислотних оксидів:
Na2CO3 + 2НСl ® 2NaCl + Н2О + СO2.
б) кисла сіль:
Na2S + H2S ® 2NaHS;
СаСО3 + Н2СО3 ® Са(НСО3)2.
в) кілька солей і вода:
NaA1O2 + 4НСl ® NaCl + АlСl3 + 2Н2O;
2NaAl(OH)4 + 4H2SO4 ® Na2SO4 + A12(SO4)3 + 8H2O.
6. Під час нагрівання оксигеновмісні кислоти розкладаються на воду та кислотний оксид:
H2SO4 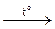 4Н2O + SO3;
4Н2O + SO3;
4НNO3 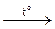 2Н2O + 4NO2 + O2.
2Н2O + 4NO2 + O2.
Солі
Солі - це продукти заміщення гідрогену кислоти металом або продуктами обміну гідроксогрупи гідроксидів металів на кислотні залишки:
H2SO4 + Zn = ZnSO4 + Н2;
Кислота Сіль
NaOH + НСl = NaCl + Н2О.
Основа Сіль
З позиції теорії електролітичної дисоціації солі– це електроліти, які під час дисоціації утворюють катіони залишку основи та аніони кислотного залишку.
Номенклатура.Назва солі складається з назви металу в називному відмінку (римською цифрою зазначається валентність металу, якщо він проявляє їх декілька), та назви кислотного залишку. Наприклад, NaCl – натрій хлорид; розчин СaSO4 – розчин кальцій сульфату; Fe(NO3)2 – ферум(ІІ) нітрат.
Фізичні властивості. Солі - це тверді кристалічні речовини. Залишки основ і кислот у солях зв'язані між собою, як правило, іонним зв'язком. Солі мають різний колір і характеризуються неоднаковою розчинністю у воді. Солі бувають середні, кислі, основні (рис. 3).
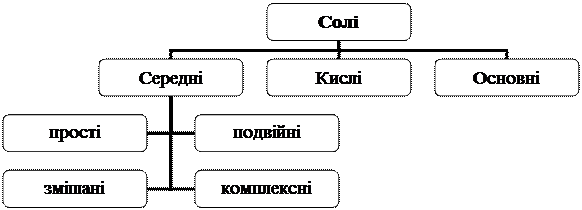
Рис. 3. Класифікація солей
Середні солі - це продукти повного заміщення Гідрогену кислоти металом або повного обміну гідроксогруп основи на кислотні залишки, наприклад:
2Na + H2SO4 ® Na2SO4 + Н2;
Fe(OH)3 + 3НClО4 ® Fе(С1О4)3 + 3Н2O.
Прості солі - це солі, до складу яких входить атоми одного металу. Наприклад, Na2SO4, Ca(NO3)2 тощо.
Якщо атоми Гідрогену в кислоті заміщуються атомами різних металів, такі солі називаються подвійними. Наприклад, KAl(SO4)2.
Коли гідроксогрупи основ обмінюються на різні кислотні залишки, то утворюються змішані солі(наприклад Са(ОСl)Сl).
Комплексні солі - це такі продукти, до складу яких входять комплексні іони: К4[Fе(СN)6], Na[Al(OH)4], Na3[Al(OH)6].
Кислі солі - продукти неповного заміщення Гідрогену багатоосновної кислоти металом, наприклад, NaHSО4, Са(НСО3)2.
Основні солі- це продукти неповного обміну гідроксогруп багатокислотної основи на кислотні залишки, наприклад:
Mg(OH)2 + HCl ® MgOHCl+ Н2O;
А1(ОН)3 + НС1 ® А1(ОН)2С1 + Н2O.
Читайте також:
- Амінокислоти як мономери білків
- Амінокислоти.
- Білки – це високомолекулярні органічні біополімери, мономерами яких є амінокислоти.
- Визначення вмісту сечової кислоти в біологічних рідинах
- Визначення точної концентрації розчину соляної кислоти.
- Двохосновні карбонові кислоти
- ДИНАМІКА АСКОРБІНОВОЇ КИСЛОТИ В ПЛОДАХ І ОВОЧАХ.
- Дія кислоти
- Дія сірчаної кислоти та сульфату амонію.
- Застосування нітратної кислоти
- ІІІ група катіонів (група сірчаної кислоти)
- КАРБОНОВІ КИСЛОТИ ТА ЇХ СОЛІ
| <== попередня сторінка | | | наступна сторінка ==> |
| ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК | | | Хімічні властивості. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |