
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
1. Обчислити швидкість хімічної реакції 2NO+O2Û2NO2, якщо концентрація нітроґен(ІІ) оксиду протягом 10 хв зменшилася від 0,2 до 0,1 моль/л.
Розв’язання
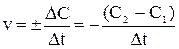 .
.
Швидкість хімічної реакції

Таким чином, середня швидкість реакції дорівнює ±0,01 моль/л×хв.
2. Визначити, у скільки разів зміниться швидкість прямої реакції NO+CO2ÛNO2+CO, якщо концентрацію нітроґен(ІІ) оксиду збільшити в 2 рази, а карбон(IV) оксиду в 3 рази.
Розв’язання
На основі закону діючих мас встановимо швидкість реакції при С1 і С2:
Швидкість реакції при С1 становить v1= k[NO][CO2]; v1 = k[1][1] = k.
Швидкість реакції при С2 - v1 = k[2][3] = k6.
Таким чином, швидкість прямої реакції збільшиться в  разів.
разів.
3.Швидкість реакції при 180°С дорівнює 0,02 моль/л×хв. Очислити швидкість цієї реакції при 210°С, якщо температурний коефіцієнт реакції 2,7?
Розв’язання
 .
.
v(t2) 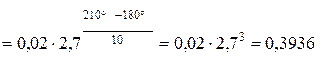 моль/л×хв.
моль/л×хв.
Таким чином, швидкість реакції при температурі 210°С дорівнює 0,3936 моль/л×хв.
4.При 30°С швидкість реакції 0,15 моль/л×хв, а при 50°С – 2,4 моль/л×хв. Розрахувати температурний коефіцієнт реакції.
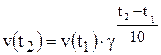
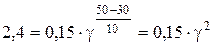 ;
;
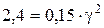 ;
;
g = 4.
Таким чином, температурний коефіцієнт реакції дорівнює 4.
5.З’ясувати, як зміниться рівновага реакції 2СО2 Û 2СО + О2 у разі підвищення тиску.
Розв’язання
 |
2СО2 Û 2СО + О2
2V 3V
У ході розв’язування задачі застосовуємо наслідок із принципу Ле Шательє. Оскільки всі речовини перебувають у газоподібному стані, то в разі підвищення тиску хімічна рівновага зміститься в бік менших об’ємів, тобто ліворуч.
Таким чином, хімічна рівновага зміститься до СО2, оскільки в лівій частині рівняння 2 об’єми, а в правій – 3.
6. Під час нагрівання суміші карбон(II) оксиду з хлором у закритому посуді встановилася рівновага CO + Cl2 « COCl2. Указати, як зміняться швидкості прямої та зворотної реакцій, якщо за незмінної температури збільшити тиск газової суміші вдвічі. Визначити, чи викличе зміна тиску зміщення хімічної рівноваги.
Розв’язання
Щоб знайти відношення швидкостей прямої та зворотної реакцій у стані рівноваги та відношення швидкостей цієї ж реакції за умов підвищеного тиску, запишемо вираз для закону діючих мас: v = K×CA(A)×CB(B).
Нехай рівноважні концентрації реагентів становлять C(CO) = а моль/л; C(Cl2) = b моль/л, C(COCl2) = с моль/л, тоді швидкість реакції у стані рівноваги дорівнюватиме: v(пр.) = К×а×в; v(зв.) = К×с.
Зі збільшенням тиску реагуючої системи у 2 рази концентрації всіх реагентів також збільшаться вдвічі. Тоді швидкості реакцій будуть відповідно дорівнювати: v¢(пр.) = К×2а×2в = 4К×а×в, v¢(зв.) = 2К×с.
Порівнюючи одержані вирази швидкостей, знаходимо, у скільки разів збільшиться швидкість прямої та зворотної реакцій:

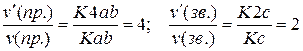 .
.
Таким чином, зі збільшенням тиску в системі у 2 рази, швидкість прямої реакції збільшиться в 4 рази, а швидкість зворотної – у 2 рази. Отже, рівновага реакції зміститься в бік утворення фосгену СОСl2.
Читайте також:
- I. Застосування похідної та інтеграла до роз’язування задач елементарної математики.
- А) Задачі, що розкривають зміст дій
- АВТОМАТИЗАЦІЯ РОЗВ’ЯЗУВАННЯ КОМПЛЕКСУ ЗАДАЧ З ОБЛІКУ ОСНОВНИХ ЗАСОБІВ ТА НЕМАТЕРІАЛЬНИХ АКТИВІВ
- Алгоритм розв’язання задачі
- Алгоритм розв’язання задачі
- Алгоритм розв’язання розподільної задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
- Алгоритм розв’язування задачі
| <== попередня сторінка | | | наступна сторінка ==> |
| ПІДСУМКИ | | | Задачі для самостійного розв’язування |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |