
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Реакції в розчинах електролітів. Іонні рівняння
Відповідно до теорії електролітичної дисоціації реакції в розчинах електролітів відбуваються між іонами.
Реакції між іонами відбуваються тільки тоді, коли в результаті їх взаємодії утворюється малорозчинна або легколетка сполука, або слабкий електроліт.
Вираження рівнянь хімічних реакцій в іонному вигляді дозволяє з’ясувати, у яких випадках реакції мають тільки один напрямок, а коли вони оборотні. Розглянемо декілька типів хімічних реакцій з позиції теорії електролітичної дисоціації та спробуємо встановити закономірності їх перебігу.
Оборотні реакції. Якщо змішати розчини натрій хлориду та калій нітрату, то ніяких змін не відбудеться. Натрій хлорид у розчині дисоціює на іони Натрію та хлориду, а калій нітрат – на іони Калію та нітрат-іони. Рівняння реакції, яка відбувається між цими речовинами має такий вигляд:
 .
.
Вихідні речовини добре розчинні у воді, є сильними електролітами і тому в розчині знаходяться у вигляді іонів. Іонне рівняння реакції можна записати так:
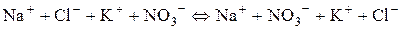 .
.
Як бачимо, і в лівій, і в правій частинах рівняння в розчині знаходяться одні й ті ж іони. Таким чином, реакція фактично не відбувається.
Розглянемо іншу реакцію:
 .
.
Запишемо її в іонно-молекулярному вигляді (усі речовини, які є сильними електролітами, записуються як іони, інші – як молекули):
 .
.
 Після скорочення однакових іонів отримуємо
Після скорочення однакових іонів отримуємо
Ця реакція є оборотною, оскільки і в лівій, і в правій частинах рівняння є недисоційовані молекули. Таким чином, ця реакція не відбувається до кінця.
Необоротні процеси. Серед практично необоротних реакцій можна виділити декілька типів.
Реакції іонного обміну можна вважати здійсненими до кінця в тих випадках, коли утворюється:
· осад
CuSO4 + 2KOH = Cu(OH)2¯ + K2SO4 − молекулярна форма;
Cu2+ + SO  + 2K+ + 2OH- = Cu(OH)2¯ + 2K+ + SO
+ 2K+ + 2OH- = Cu(OH)2¯ + 2K+ + SO  − повна іонна форма;
− повна іонна форма;
Cu2+ + 2OH- = Cu(OH)2¯ − скорочена іонна форма;
· газ
Na2CO3 + 2HCl Û 2NaCl + H2CO3,
2Na+ + CO 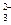 + 2H+ + 2Cl- Û 2Na+ + 2Сl- + H2O + CO2,
+ 2H+ + 2Cl- Û 2Na+ + 2Сl- + H2O + CO2,
CO 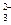 + 2H+ Û H2O + CO2;
+ 2H+ Û H2O + CO2;
· слабкий електроліт (Н2О)
KOH + HNO3 Û KNO3 + Н2О;
K+ + OH- + H+ + NO  Û K+ + NO
Û K+ + NO  + Н2О;
+ Н2О;
OH- + H+ Û Н2О.
Під час написання рівнянь іонних реакцій у розчинах електролітів треба враховувати, що:
1) прості речовини, оксиди, а також нерозчинні речовини не дисоціюють;
2) якщо малорозчинна речовина утворюється в результаті реакції, то в іонному рівнянні її вважають нерозчинною;
3) сума зарядів іонів ліворуч і праворуч повинна бути однаковою;
4) подавати слід три рівняння: повне молекулярне, повне іонне та скорочене іонне.
Читайте також:
- V Процес інтеріоризації забезпечують механізми ідентифікації, відчуження та порівняння.
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- VІI. Утворіть вищий та найвищий ступені порівняння від прислівників із вправи VI.
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналітичні реакції (реактиви)
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антиген - це полімер органічної природи, генетично чужерідний для макроорганізма, при потраплянні в який викликає імунні реакції, що направлені на його видалення.
- Антигени. Антитіла. Серологічні реакції .
- Асимптотичний підхід до порівняння оцінок
- Аукціонні торги
- Біогенні аміни та реакції декарбоксилювання
| <== попередня сторінка | | | наступна сторінка ==> |
| Теорія електролітичної дисоціації Арреніуса | | | Константа електролітичної дисоціації |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |