
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Організація системи управління документацією на фармацевтичному підприємстві
На сьогодні в Україні виробництво фармацевтичної продукції відбувається в двох напрямках:
- на несертифікованих за GMP дільницях, зокрема для виробництва традиційних лікарських засобів,
- на сертифікованих за вимогами GMP дільницях.
Але, незважаючи на те, що форми і вимоги до нормативної документації мають свої особливості в таких випадках, при побудові систем якості на будь-якому фармацевтичному виробництві першочергове та обов’язкове значення має документування всіх виробничих процесів. Від того, наскільки чітко визначена структура документації і робота з нею, залежить чіткість функціонування всієї системи якості підприємства. Не випадково процес створення і ведення документації вважають однією з найбільш відповідальних, трудомістких і складних проблем при впровадженні GMP. Це пов’язано як з труднощами при розробці документації, так і з труднощами, пов’язаними з навчанням персоналу належному її веденню.
Документація системи якості фармацевтичного підприємства є повним описом системи і методик, яким необхідно слідувати для правильного здійснення його діяльності. Вона уможливлює відтворення сутності і послідовності виконуваних дій.
| Основні напрями функціонування біофармацевтичного підприємства, які забезпечує документація |
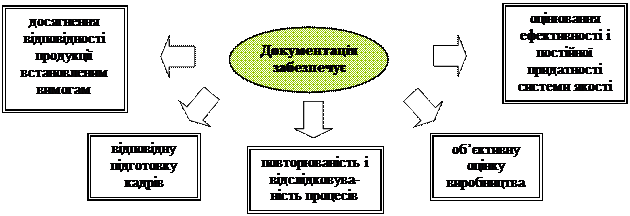
Від того, наскільки чітко визначена структура документації, наскільки добре організована робота по розробці і обороту процедур залежить чіткість функціонування всієї системи якості. Не випадково процес створення і ведення документації вважають однією з найбільш відповідальних, трудомістких і складних проблем при впровадженні GMP.
Документація дає можливість передати зміст та послідовність виконуваних дій. Її використання сприяє:
Ø досягненню відповідності продукції встановленим вимогам;
Ø забезпечення відповідної підготовки кадрів;
Ø повторності та прослідковуваності процесів;
Ø забезпечення ефективності та постійної придатності системи якості.
На питання, хто зазвичай займається підтримкою системи документації відповісти дуже складно. Це залежить від організаційної структури підприємства, його розмірів, діяльності тощо. Тому на одному підприємстві цим може займатися декілька підрозділів, в інших - певна вибрана для цього людина, а в третіх - особа, якій цей обов’язок доручений за сумісництвом (технолог виробництва і т.п.).
Згідно з нижчеприведеною схемою відповідальність за документацію розподіляється наступним чином:
Ø Уповноважена особа(директор з якості)-здійснюєзагальне керівництво та постановку завдань, контроль за виконанням;
Ø Начальник відділу управління якістю -проводитьпланування та узгодження документів, які знову розробляють, контроль своєчасності перегляду діючих документів та їх відповідності новим законодавчим та нормативним вимогам та прийнятим технологічним рішенням;
Ø Інспектор з контролю документації - задіяний у поточній роботі по дотриманню порядку обліку документів та ефективності функціонування системи документації;
Ø Інженер з якості відділу контролю якості (інженер-технолог з питань GMP) -проводитьрозробку, адаптування та введення в дію виробничо-технологічної документації (специфікацій, технологічних інструкцій, тощо).
| Орієнтовна посадова схема системи управління документацією на фармацевтичному підприємстві. |

Подібна схема керівництва документацією на фармацевтичному виробництві дозволяє створити рівновагу між підрозділами заводу внаслідок організації ефективного зворотного зв’язку між структурами прямого та функціонального підпорядкування, забезпечення єдиного інформаційного простору, координації прямої взаємодії співробітників різних підрозділів і своєчасної діагностики «розривів» і «бар’єрів» в документації (документи повинні бути адекватні один одному).
Всі документи на фармацевтичному виробництві поділяють на:
Ø зовнішні (закони, накази, національні і галузеві нормативні документи – ДСТУ, ГСТУ, ТУ, ДФУ.
Ø внутрішні (опрацьовані та затверджені на підприємстві – технологічні інструкції, методики, специфікації, досьє виробничої ділянки, протоколи виробництва, тощо).
Крім такого поділу документації фармацевтичного підприємства також запропонована ієрархічна структура документації, яка включає чотири рівні.
| Ієрархічна структура документації на фармацевтичному підприємстві |

 |

.
Функціонування системи документації включає етапи: розробки та підготовки у відповідності до реєстраційного досьє та досьє виробничої ділянки, затвердження, розповсюдження, регулярний перегляд та підтримку відповідно до вимог, внесення змін, яке передбачає проходження відповідних етапів, починаючи із затвердження.
Для ідентифікації контрольованої документнації на підприємстві прийнята відповідна система кодування документів. Після затвердження документа контролер документів в обов’язковому порядку присвоює код документу, який вказується на кожній сторінці в колонтитулах. Код контрольованих документів складається з комбінації букв і цифр і має наступний вигляд:
Читайте також:
- A. Організація уроку.
- C. 3. Структурна побудова управління організаціями.
- ERP і управління можливостями бізнесу
- H) інноваційний менеджмент – це сукупність організаційно-економічних методів управління всіма стадіями інноваційного процесу.
- I. Органи і системи, що забезпечують функцію виділення
- I. Організація класу до уроку та повторення правил техніки безпеки.
- I. Особливості аферентних і еферентних шляхів вегетативного і соматичного відділів нервової системи
- II. Анатомічний склад лімфатичної системи
- II. Організація і проведення спортивних походів
- II. Організація перевезень
- II. Організація перевезень
- III. КОНТРОЛЬ і УПРАВЛІННЯ РЕКЛАМУВАННЯМ
| <== попередня сторінка | | | наступна сторінка ==> |
| Загальні вимоги GMP до технологічного процесу | | | ААА – ВВ – ОООО – ОО – ОО |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |