
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Водневий зв’язок
Водневий зв'язок — це специфічний зв'язок за участю атома Гідрогену.
Водневий зв'язок — це зв'язок між позитивно поляризованим атомом Гідрогену і негативно поляризованим іншим атомом.
Оскільки атоми можуть належати до однієї або до різних молекул, то цей зв'язок може бути міжмолекулярним або внутрішньомолекулярним. Міжмолекулярний водневий зв'язок — це зв'язок між позитивно поляризованим атомом Гідрогену однієї молекули і негативно поляризованим атомом іншої молекули. Внутрішньомолекулярний водневий зв'язок — це зв'язок між позитивно поляризованим атомом Гідрогену і негативно поляризованим атомом, що входять до складу однієї молекули.
Водневий зв'язок звичайно позначають крапками. Цим указується, що він набагато слабкіше ковалентного зв'язку (приблизно в 15-20 разів). Енергія водневого зв'язку становить 8-40 кДж/моль. За допомогою міжмолекулярного водневого зв'язку відбувається асоціація молекул. Утворення димерів води можна представити схемою:
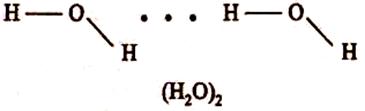
Водневі зв'язки легко руйнуються при нагріванні. При температурі нижче 0 °С усі молекули води асоційовані; при 0 °С руйнується 15% водневих зв'язків; при +20 °С руйнується 50% водневих зв'язків. Молекули водяної пари (+100 °С) не утворюють водневих зв'язків.
Водневий зв'язок утворюється за допомогою донорно-акцепторної взаємодії. Йому властиві спрямованість у просторі і насичуваність. Цей зв'язок відіграє велику роль у хімії органічних сполук і в здійсненні біохімічних процесів.
Читайте також:
- Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями.
- Антиінфляційна політика. Взаємозв’язок інфляції та безробіття.
- Біосфера, її складові, взаємозв’язок між ними.
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Взаємозв’язок бюджету з іншими фінансовими планами
- Взаємозв’язок витрат і доходу. «Хрест» Кейнса
- Взаємозв’язок економічних і бухгалтерських витрат і прибутку
- Взаємозв’язок елементів управління
- Взаємозв’язок етики з іншими науками, що вивчають мораль
- Взаємозв’язок з освітніми системами інших країн, відповідність вищої освіти України світовому рівню.
- Взаємозв’язок інфляції та безробіття.
- Взаємозв’язок корупції та організованій злочинності.
| <== попередня сторінка | | | наступна сторінка ==> |
| Йонний зв’язок | | | Металічний зв’язок |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |