
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Фізичні та хімічні властивості металів
Фізичні властивості металів.Метали мають особливий, металевий, блиск, здатні проводити електричний струм. Ці властивості спричинені наявністю в них усуспільнених електронів, які також зумовлюють високу теплопровідність металів.
Більшість металів є пластичними; їх можна кувати, витягувати з них дріт. При механічному обробленні металу шари катіонів зсуваються один щодо одного. Проте металічний зв'язок при цьому не руйнується, оскільки його забезпечують делокалізовані електрони, що є своєрідним «мастилом» між катіонами.
Температури плавлення більшості металів перевищують 1000 °С. Метали, які плавляться за нижчої температури (наприклад, свинець, олово, цинк, алюміній), називають легкоплавкими. Найтугоплавкіший метал — вольфрам (т. пл. 3420 °С). Найнижчу температуру плавлення має ртуть (–38,9 °С).
Значення густини металів перебувають у широкому інтервалі — від 0,534 (літій) до 22,5 г/см3 (осмій).
Метали різняться й за твердістю. Найтвердішим є хром; ним можна різати скло. Найм'якші метали — натрій, калій, свинець.
Колір металів звичайно білий або сірий. Золото і цезій мають жовтий колір, а мідь — червоний.
Залізо, кобальт і нікель є феромагнетиками — речовинами, які здатні намагнічуватися в зовнішньому магнітному полі і зберігати такий стан.
Хімічні властивості металів. Реакції з неметалами.Атоми металічних елементів у хімічних реакціях завжди віддають електрони. Тому метали, взаємодіючи з різними рочонинами, є відновниками.
Активні метали реагують із багатьма неметалами за звичайних умон, а менш активні – за підвищеної температури. Інколи нагрівання потрібне лише для того, щоб реакція розпочалася, а далі вона триває мимовільно із виділенням теплоти. Золото взаємодіє лише з галогенами й не реагує з киснем та іншими неметалами.
Приклад реакції металу із неметалом за наявності каталізатора — води:
Н2О
Zn + I2 = ZnІ2.
Реакції з водою.За звичайних умов з модою взаємодіють лужні та лужноземельні метали. Продуктами кожної реакції є луг і водень. Аналогічна реакція за участю магнію відбувається при нагріванні.
Напишіть рівняння реакції барію з водою, складіть схеми окиснення і відновлення.
Деякі менш активні метали взаємодіють лише з водяною парою за високої температури.
Продукти цих реакцій — оксиди металічних елементів і водень:
tº
Мn + Н2О = МnО + Н2↑.
Реакції з кислотами.Для прогнозування можливості реакції між металом і кислотою (а також сіллю) використовують ряд активності металів:
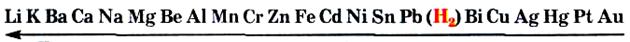
Посилення відновних властивостей (хімічної активності) металів
Метали, розміщені зліва від водню, взаємодіють із такими кислотами, як хлоридна НСl, ортофосфатна Н3РО4, сульфатна Н2SО4 (у розбавленому розчині), з виділенням водню, а розміщені справа не реагують із ними:
Ni + Н2SО4 (розб.) = NiSО4 + Н2↑;
Сu + НСl ≠ .
Окисником у реакціях металів із цими кислотами є Гідроген.
Під час реакцій металів із нітратною і концентрованою сульфатною кислотами водень не виділяється, а утворюються інші речовини. Елементами-окисниками в цих кислотах є Нітроген і Сульфур:
Mn + HNO3 (сильно розб.) → Mn(NO3)2 + NH4NO3 + H2О.
Нітратна і концентрована сульфатна кислоти взаємодіють навіть із металами, розміщеними в ряду активності після водню (крім золота і платини):
tº
Нg + H2SO4 (конц.) → HgSO4 + SO2↑ + Н2О.
Перетворіть схеми двох останніх реакцій на хімічні рівняння, дібравши коефіцієнти методом електронного балансу.
Реакції з лугами.Із лугами взаємодіють цинк, алюміній, олово, свинець, берилій, кілька інших металів. Така реакція можлива за одночасного виконання двох умов: 1) метал перебуває в ряду активності зліва від водню; 2) оксид (гідроксид) відповідного металічного елемента є амфотерним. Продукти реакції — сіль і водень:
Zn + 2KОH = K2ZnО2 + Н2↑.
калій цинкат
Якщо взаємодія відбувається у водному розчині, то утворюється сіль іншого складу:
Zn + 2КОН + 2Н2О = K2[Zn(OH)4] + H2↑.
калій тетрагідроксоцинкат
Скласти формулу сполуки K2[Zn(OH)4] можна, замінюючи у формулі цинкату K2ZnО2 кожний атом Оксигену (двовалентний) на дві ОН-групи (одновалентні). Така сіль у водному розчині дисоціює на йони К+ і [Zn(OH)4]2-.
Рівняння цієї реакції у йонно-молекулярній формі:
Zn + 2OH¯ + 2Н2О = [Zn(OH)4]2- + H2↑.
Реакції з розчинами солей.Метали взаємодіють із солями у водному розчині з утворенням інших металів і солей:
Zn + (CH3COO)2Pb = Pb + (CH3COO)2Zn;
Zn + Pb2+ = Pb + Zn2+.
Такі реакції відбуваються, якщо метал-реагент активніший за метал-продукт, тобто розміщений у ряду активності зліва від нього. Крім того, вихідна сіль має бути розчинною у воді, оскільки беруть її розчин.
Іноді в результаті взаємодії металу із сіллю утворюються дві нові солі:
Сu + 2FеСl3 = СuСl2 + 2FеСl2.
Цей процес спрощено описують такою схемою:
Fе + О2 + Н2О → Fе(ОН)3.
Читайте також:
- А/. Фізичні особи як суб’єкти цивільного права.
- Аеродинамічні властивості колісної машини
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- Анізотропія властивостей металів.
- Атомно-кристалічна структура металів
- Атрибутивні ознаки і властивості культури
- Білки, властивості, роль в життєдіяльності організмів.
- Біосфера Землі, її характерні властивості
- Біохімічні зміни в організмі при розтренуванні і перетренуванні
- Біохімічні основи розвитку витривалості
- Біохімічні основи розвитку силових і швидкісних якостей
| <== попередня сторінка | | | наступна сторінка ==> |
| Місце металічних елементів у періодичній системі. Загальна характеристика металів | | | Характеристика й екологічна значимість окремих представників металічних елементів і їх сполук |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |