
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Класифікація колоїдно-дисперсних систем за агрегатним станом
Таблиця 1.1
Суспензія — дисперсна система з рідким дисперсійним середовищем та твердою дисперсною фазою. На відміну від високодисперсних систем, в суспензії частинки відносно швидко седиментують (випадаюсть в осад, або зрідка спливають на поверхню дисперсійної рідини).
Ему́льсія — дисперсна система з рідким дисперсійним середовищем та рідкою дисперсною фазою.
Класифікація за агрегатним станом
У залежності від агрегатного станудисперсної фази і дисперсійного середовища всі дисперсні системи можна розділити на 9 типів (таблиця 1.1). Скорочено тип КДС записують звичайно у вигляді дробу з індексом: перша буква назви стану дисперсної фази в чисельнику, і з індексом дисперсійного середовища – у знаменнику.
Необхідною умовою утворення дисперсної системи є обмежена розчинність речовини дисперсної фази в дисперсійному середовищі. Так, системи Г/Г раніше не фігурували у класифікації внаслідок необмеженої взаємної розчинності газів. Але за рахунок флуктуацій густини гпзів в атмосфері Землі можуть утворюватися системи типу Г/Г. Тому в сучасну класифікацію колоїдно-дисперсних систем включено системи типу Г/Г.
| № п/п | Тип колоїдно-дисперсної системи | Скоро-чений запис | Приклади |
| 1. | Тверда дисперсна фаза у твердому дисперсійному середовищі | Т/Т | Сталь, чавун, багато сплавів, деякі штучні дорогоцінні камені (рубін, агат), кольорове скло, синя кам’яна сіль, чорний алмаз |
| 2. | Рідка дисперсна фаза у твердому дисперсійному середовищі | Р/Т | Деякі штучні суміші (вода в парафіні), природні мінерали з рідкими включеннями |
| 3. | Газоподібна дисперсна фаза у твердому дисперсійному середовищі | Г/Т | Пемза, туфи, морська пінка, мікропористі ебоніти і резини, пінопласт |
| 4. | Тверда дисперсна фаза у рідкому дисперсійному середовищі | Т/Р | Колоїдні розчини золота, срібла, платини, бісмута, олова, синтетичні латекси, суспензія глини у воді |
| 5. | Рідка дисперсна фаза у рідкому дисперсійному середовищі | Р/Р | молоко, емульсії олії у воді, води в нафті, бензину у воді, деякі креми, мазі |
| 6. | Газоподібна дисперсна фаза у рідкому дисперсійному середовищі | Г/Р | Піни (мильна піна) |
| 7. | Тверда дисперсна фаза у газоподібному дисперсійному середовищі | Т/Г | Аерозолі: тютюновий дим, пил, димова завіса |
| 8. | Рідка дисперсна фаза у газоподібному дисперсійному середовищі | Р/Г | Аерозолі: хмари, тумани |
| 9. | Газоподібна дисперсна фаза у газоподібному дисперсійному середовищі | Г/Г | Системи, які утворюються внаслідок флуктуацій густини газів у атмосфері Землі |
Системи з газовим дисперсійним середовищем незалежно від природи газу називають аерозолями.
Системи з рідким середовищем – ліозолями. Залежно від природи рідини ліозолі ділять на гідрозолі, органозолі, бензозолі й т.д.
З табл. 1.2 видно, що всі дисперсні системи за кінетичними властивостями дисперсної фази діляться на два класи: вільнодисперсні системи, у яких дисперсна фаза рухлива, і зв’язанодисперсні системи – системи із твердим дисперсійним середовищем, у якій частки дисперсної фази не можуть вільно пересуватися.
Класифікація за міжфазною взаємодією
Взаємодія між речовинами дисперсної фази і дисперсійного середовища за рахунок міжмолекулярних сил на межі поділу фаз протікає завжди, але ступінь її прояву може бути різним.
У залежності від цього дисперсні системи можуть бути ліофільними чи ліофобними. Для перших характерна сильна міжмолекулярна взаємодія речовини дисперсної фази із середовищем, а для других – слабка. Ця взаємодія приводить до утворення сольватних (гідратних у випадку води) оболонок з молекул дисперсійного середовища навколо частинок дисперсної фази, і, як у звичайних розчинах, називається сольватацією (гідратацією).
Ліофільні системи термодинамічно стійкі (ΔG ≤ 0) і характеризуються самочинним диспергуванням. Воно можливе за умови, коли зростання вільної енергії Гіббса ΔG, пов’язане зі збільшенням поверхні при диспергуванні, компенсується зменшенням ентальпії в процесі сольватації і ростом ентропії системи за рахунок поступального руху частинок, що утворюються. Так, мила, багато глин самочинно «розпускаються» у воді, а високомолекулярні сполуки розчиняються в “гарному” (такому, який добре взаємодіє з ними) розчиннику до окремих макромолекул. Системи, у яких самочинного диспергування не відбувається, можуть бути названі ліофобними, але ліофілізованими в тому чи іншому ступені.
Отже, сучасна колоїдна хімія вивчає системи, структурні одиниці яких складаються з багатьох тисяч атомів і утворюють трьох- і двовимірні структури і макромолекулярні системи.
Розглянувши зміст і форму науки – колоїдної хімії, можна дати її визначення. Існує декілька різних формулювань; однак найбільш удалим уявляється визначення Жукова: колоїдна хімія вивчає властивості високодисперсних гетерогенних систем на основі поверхневих явищ, а також фізико-хімічні властивості високомолекулярних сполук і їх розчинів.
3. Розрізняють 2 групи методів отримання колоїдних розчинів: Дисперсійний метод полягає в подрібнення речовини до маленьких частинок. Подрібнення можна вести:
1) механічним способом (кульові млини, гомогенізатори, ультразвукові дезінтегратори);
2) фізико-хімічним способом – метод пептизації, коли осад речовини переводиться в колоїдний стан додаванням поверхнево–активних сполук - мила, білків.
Конденсаційний метод спрямований на збільшенні розмірів частинок завдяки агрегації молекул або іонів. Для цього використовується: 1) випаровування розчинника, внаслідок чого йде конденсація твердої фаза; 2) заміна розчинника, наприклад, коли спиртовий розчин холестерину вилити у воду; 3) використання реакцій, в яких осади формуються з маленьких
частинок. Так, отримання колоїдного розчина йодиду срібла йде за реакцією заміщення:
KJ + AgNO3 → AgJ ↓ + KNO3
Колоїдні розчини можна отримувати в реакціях відновлення чи окислення, або гідролізу:
Ag2O + H2 → 2Ag↓ + H2O
2HAuCl4 + 3 H2O2 → 2 Au↓ + 8 HCl + 3O2
2H2S + SO2 → 3S↓ + 2Н2О
FeCl3 + 3H2O → Fe(OH)3↓ + 3HCl
3. Метод пептизації.Пептизацію тільки умовно можна віднести до диспергаційних методів одержання колоїдних розчинів, оскільки в цьому методі відсутній процес подрібнення частинок великого розміру до колоїдного ступеня дисперсності.
Розрізняють три способи пептизації: адсорбційну (безпосередню), дисолюційну (хімічну або посередню), а також промивання осаду розчинником (дисперсійним середовищем).
Адсорбційна пептизація відбувається тоді, коли до промитого дистильованою водою осаду додають електроліт, який містить йон, що може вибірково адсорбуватись на агрегаті, утворюючи міцелу. Наприклад, золь ферум(ПІ) гідроксиду можна одержати таким чином. За реакцією
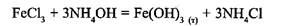
одержують червоно-бурий осад Fe(OH)3. Осад фільтрують, декілька разів промивають дистильованою водою, вимиваючи йони електролітів. При додаванні невеликої кількості пептизатора – солі FeCl3 – осад дезагрегується, утворюючи червоно-бурий золь Fe(OH)3. Будова міцели золю така:
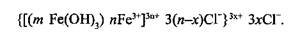
Такого самого ефекту можна досягти, використовуючи в ролі пептизатора розчин лугу.
За дисолюційної пептизації на частинках осаду адсорбуються не йони використаного електроліту, а продукти його взаємодії з поверхневими молекулами осаду. За такої пептизації дуже важливо, щоб кількість реагенту, який розчиняє осад, була малою, інакше може розчинитись весь осад.

Пептизації промиванням розчинником (дисперсійним середовищем) зазнають осади, які були одержані за умови значного надлишку одного із реагентів. У цьому випадку подвійний електричний шар на частинках осаду дуже стиснутий і електростатичні сили відштовхування між частинками осаду не виявляються. Щоб відновити останні і створити нормальну структуру подвійного електричного шару, необхідно зменшити концентрацію електроліту шляхом промивання осаду розчинником або дисперсійним середовищем. За цих умов надлишок електроліту вимивається і утворюється стійкий золь.
Наприклад, міцела золю Fe(OH)3, одержаного за значного надлишку FeCl3, має таку будову:

Після промивання осаду водою міцела має такий вигляд:

Читайте також:
- Active-HDL як сучасна система автоматизованого проектування ВІС.
- I. Органи і системи, що забезпечують функцію виділення
- I. Особливості аферентних і еферентних шляхів вегетативного і соматичного відділів нервової системи
- II. Анатомічний склад лімфатичної системи
- II. Бреттон-Вудська система (створена в 1944 р.)
- II. Класифікація видатків та кредитування бюджету.
- III етап. Системний підхід
- IV. Розподіл нервової системи
- IV. Система зв’язків всередині центральної нервової системи
- IV. УЗАГАЛЬНЕННЯ І СИСТЕМАТИЗАЦІЯ ВИВЧЕНОГО
- IV. Філогенез кровоносної системи
- OSI - Базова Еталонна модель взаємодії відкритих систем
| <== попередня сторінка | | | наступна сторінка ==> |
| Класифікація дисперсних систем | | | Міцелярна теорія будови колоїдних частинок |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |