
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Будова альдоз.
План
Тема 2
План
У харчових процесах
Тема 1
Додаткова
1. Смоляр В.І. Фізіологія та гігієна харчування. – К.: Здоровя, 2000.-336 с.
2. Позняковський В.М. Гигиенические основы питания, качество и безопасность пищевых продуктов. – Новосибирск: Сиб. Унив. Изд-во, 2005.- 522 с.
3. Тутельян В.А., Спириче В.Б., Суханов Б.П., Кудашева В.А. Микронутриенты в питании здорового и больного человека (справочное руководство по витаминам и минеральным веществам). – М.: Колос, 2002. – 424 с.
5. Основи фізіології харчування/Н.В. Дуденко, Л.Ф. Павлоцька, В.С. Артеменко, М.В. Кривоносов, І.С. Кратенко: Підручник. – Х.: Торнадо, 2003. – 407 с.
Білки. Будова, властивості, перетворення
1. Будова білків, властивості, класифікація
2. Функціональні властивості білків
3. Перетворення білків у харчових технологіях
4. Значення білків у життєдіяльності людини
5. Методи визначення білків
1. Будова білків, властивості, класифікація
Білки – найважливіша складова продуктів харчування. Без білка немає життя – це істина згадується при кожному описанні живої матерії. Існує нескінченний цикл – перетворення азоту для біосинтезу амінокислот і білків.
Тварини використовують у їжу рослини, асимілюють амінокислоти і перетворюють їх у власні білки.
Людина використовує у їжу тваринні і рослинні продукти, перетворюючи амінокислоти їжі у власні тканинні білки.
Після смерті живих організмів органічні молекули розкладаються мікроорганізмами, азот поступає у грунт, який асимілюється фіксуючими бактеріями і перетворюються у органічні речовини і цикл повторюється.
Білками або протеїнами (від грецького слова protos – перший, первісний) називають високомолекулярні природні азотовмісні сполуки, молекули яких побудовані із залишків амінокислот.
Білки – найскладніші речовини із усіх сполук живої тканини.
До складу білків входять п’ять елементів: азот, вуглець, кисень, водень, сірка приблизно у таких кількостях(%):
вуглець -50-54, азот – 15-18, кисень -20-23, водень -6-8, сірка -0,3-2,5.
Амінокислоти являються будівельними блоками білків. Білки синтезуються із амінокислот і перетворюються в амінокислоти при перетравлюванні (гідролізі) у шлунково-кишковому тракті.
Природних амінокислот нараховується біля 200, а до складу білків входять лише 20 індивідуальних амінокислот.
Молекули амінокислот містять декілька функціональних груп, які визначають їх властивості: аміногрупа – NH2; карбоксильна група – СООН і амінокислотний радикал - R, що має різну будову: від 1 до 7 атомів вуглецю.
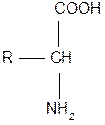
Загальна формула амінокислот
Яким же чином вони зв’язані у молекулі білка?
При вивченні властивостей білків і їх будови вченими було установлено, що між молекулами амінокислот існує так званий пептидний зв’язок або його ще називають кислотно-амідним зв’язком, завдяки якому утворюються ди -, три -, тетра -, пентапептиди).

Схема пептидного зв’язку
У білковій молекулі крім поліпептидних є ще дисульфідні зв’язки – S – S -, які з’єднують між собою окремі пептидні ділянки одного і того ж поліпептидного ланцюга, утворюючи спіраль.
Розглянемо деякі властивості амінокислот.
1. У продуктах харчування містяться лише 20 амінокислот. Ці амінокислоти поділяються на замінні і незамінні
Класифікація амінокислот
| Класифікація | Амінокислоти |
| Незамінні (ессенціальні) амінокислоти | 2. Ізолейцин 3. Лейцин 4. Лізин 5. Метіонін 6. Фанілаланін 7. Треонін 8. Триптофан 9. Валін |
| Замінні амінокислоти | 1. Гліцин 2. Глутамінова кислота 3. Аргінін 4. Аспарагінова кислота 5. Пролін 6. Аланін 7. Серин 8. Тирозин 9. Цистеін 10. Аспарагін 11. Глутамін 12. Гистидин |
Замінні амінокислоти можуть синтезуватися в організмі людини, а незамінні повинні надходити у готовому вигляді з білками їжі.
Залежно від вмісту незамінних амінокислот білки поділяються на повноцінні і неповноцінні.
Повноцінні білки є у багатьох продуктах тваринного походження. Більшість же білків рослинного походження, крім білків бобових, горіхів, насіння соняшнику – неповноцінні. Вони містять малу кількість лізину, ізолейцину і треоніну.
Основною функцією амінокислот є участь їх у синтезі білків.
Інтенсивність синтезу білків зумовлена його амінокислотним складом. Чим вища біологічна цінність білка харчових продуктів, що споживаються людиною, тим краще він використовується для синтезу власних білків і функціонування організму.
Якість харчового білка може бути оцінена шляхом порівняння його амінокислотного складу з амінокислотним складом стандартного чи "ідеального білка".
Поняття "ідеальний білок" включає поняття про гіпотетичний білок високої харчової цінності, що задовольняє потреби організму.
Для дорослої людини в якості ідеального білка використовують амінокислотну шкалу Комітету ФАО/ВООЗ, яка показує вміст кожної незамінної амінокислоти у 1г стандартного білка.
Для визначення біологічної цінності білків використовують хімічні, біологічні та розрахункові методи.
Хімічні методи засновані на експериментальному визначенні кількості всіх амінокислот, наприклад у амінокислотному аналізаторі, які містяться у досліджуваному продукті.
Отримані дані порівнюють з "ідеальним білком".
Підраховують відсотковий вміст кожної з амінокислот відносно її вмісту в ідеальному білку за формулою:


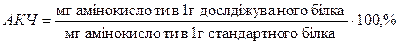
Розрахунок виражають у відсотках. Це значення називають амінокислотним числом – скором (скор – рахунок).
Лімітуючою амінокислотою, що обмежує біологічну цінність білка, вважається та, скор (%) якої має найменше значення.
АКЧ білків деяких основних продуктів: куряче яйце – 1; коров’яче молоко – 0,95; соя – 0,55; рис – 0,67; пшениця – 0,53.
Зазвичай розраховують скор для трьох найбільш дефіцитних амінокислот (лізин, метіонін, триптофан 3:3:1).
За шкалою ФАО ідеальний білок містить (мг/г): лейцину – 70; тирозину – 60; лізину – 55; валіну – 50; ізолейцину – 40; треоніну – 40; метіоніну – 35; триптофану – 10.
Співвідношення суми незамінних амінокислот (АК) до суми замінних не повинно бути нижчим 0,4.
Розглянемо деякі фізико-хімічні властивості АК.
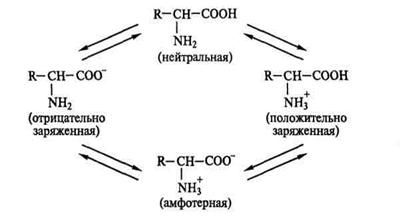
Оскільки АК у своєму складі мають як основні групи ( - NH2), так і кислотні ( - СООН), вони відносяться до амфотерних електролітів, тобто сполукам, що проявляють властивості як кислот, так і лугів (від грецького слова amphi – обидві).
Аміногрупа амінокислот іонізована дещо менше, ніж карбоксильна група, і водний розчин амінокислот має слабо кислий характер.
В розчині можливо існування чотирьох електрохімічних форм АК:
|
На іонізацію АК у водних розчинах впливає рН середовища. У кислому середовищі висока концентрація протонів подавлює дисоціацію карбоксильних груп і амінокислоти заряджаються позитивно – тобто переходять у форму катіонів.
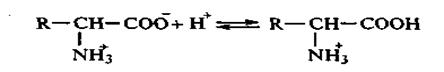
|
У лужному середовищі при надлишку ОН+-іонів АК знаходяться у вигляді аніонів за рахунок дисоціації протонованих аміногруп
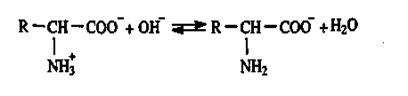
|
Таким чином величина електричного заряду АК знаходиться у тісному взаємозв’язку з рН середовища.
У розчині з рН між 4 і 9 (водні розчини) АК існують у вигляді цвіттер-іонів.
Стан амінокислоти, коли її сумарний електричний заряд дорівнює нулю, називається ізоелектричним, значення рН, що обумовлює цей стан, називається ізоелектричною точкою амінокислоти (рІ).
В ізоелектричні точці ІЕТ АК мають мінімум розчинності, мінімальну буферну ємність.
З якими хімічними речовинами можуть взаємодіяти АК?
Завдяки наявності карбоксильних і аміногруп АК можуть брати участь у специфічних хімічних реакціях, які використовуються при розділенні, ідентифікації і кількісному визначенні АК.
АК легко утворюють солі, складні ефіри і інші сполуки, гідразиди, азиди, тіоефіри, галогенангідриди: АК можуть взаємодіяти (вступати в реакцію) зі спиртами, утворюючи складні ефіри, з азотистою кислотою (НNO2), утворюючи оксикислоту і газоподібний азот, з формальдегідом, для ідентифікації і кількісного аналізу АК використовують реакцію з нінгідрином – кольорова реакція.
Але основною реакцією, яка має суттєве значення у технологіях харчових продуктів, є реакція амінокислот з редукуючими речовинами. Ці речовини взаємодіють при нагріванні до температури 100-1050C, а її реакція одержала назву Майяра (1912 р). Її ще називають реакцією меланоідиноутворення.
Реакція Майяра остаточно не вивчена, вона складна, протікає через ряд проміжних стадій.
Меланоідини – важливі компоненти харчових продуктів. Однак, слід наголосити, що реакція Майяра є причиною зменшення цінних компонентів їжі (амінокислот і цукрів) із-за того що меланоідини практично не засвоюються організмом людини.
Але при кулінарній обробці харчових продуктів меланоідини беруть участь у формуванні смаку, запаху і кольору харчових продуктів.
Так, колір, аромат свіжовипеченого хліба, колір квасу, пива, кип’яченого молока, м’ясних виробів, що піддані кулінарній обробці, особливо смаженню, колір сушених плодів і овочів – у більшості визначається реакцією меланоідиноутворення.
Навпаки, у виробництві цукру, меланоідини не бажані так як вони обумовлюють високу в’язкість уварюваних сиропів і загальмують процес кристалізації у них цукрози.
Особливості будови молекул деяких амінокислот
Амінокислоти у яких амінокислотний радикал представлений циклічною структурою, називаються ароматичними (тирозин, триптофан, фенілаланін).
До складу сірковмісних амінокислот - цистеіна, цистина і метіоніна входить атом сірки.
Деякі АК мають у боковому ланцюгу другий атом азоту (лізин, аргінін, гістидин), що надають АК основних властивостей.
АК, боковий ланцюг яких розгалужений, називаються амінокислотами з розгалуженим боковим ланцюгом (лейцин, ізолейцин, валін).
За просторовою структурою білки поділяють на глобулярні і фібрілярні.
Глобулярні білки – складаються з одного чи декількох поліпептидних ланцюгів, щільно звернутих за рахунок (нековалентних чи ковалентних) зв’язків у компактну частку, яка називається глобулою.
Зазвичай вони добре розчиняються у воді. До цієї групи відносяться: ферменти, антитіла, багато гормонів, білки-переносники кисню (міоглобін, гемоглобін, сивороточний альбумін (переносник жирних кислот)).
Фібрілярні білки складаються із витягнутих чи спіралезованих поліпептидних ланцюгів, розташованих паралельно, що утримуються разом за рахунок багаточисельних зв’язків. Поліпептидні ланцюги об’єднані у волокна (фібрили). Такі білки не розчиняються у воді. Із них побудовані волосся, нігті, перини (кератини), сухожилля (колаген), зв’язки (еластин), шовк, павутина (фіброїн).
Слід підкреслити, що більшість білків мають глобулярну форму.
За способом зворачування і асоціації поліпептидних ланцюгів, виділено чотири рівні просторової структури білка:
- первинна;
- вторинна;
- третинна;
- четвертинна.
Первинна структура – це каркас білкової молекули, амінокислотні залишки якої лінійно з’єднані між собою кислотно-амідними (пептидними) зв’язками. Для кожного білка послідовність АК в поліпептидних ланцюгах є характерною, унікальною.
Вона визначається генетично і визначає вищі рівні організації даного білка. Заміна навіть одного амінокислотного залишку поліпептидного ланцюга, який складається із сотень АК, може суттєво змінити властивості даного білка і навіть повністю позбавити його біологічної активності.
Пептидний зв'язок за своєю хімічною природою є ковалентний зв'язок, що надає первинній структурі високу міцність. Енергія зв’язку 140-400 кДж/моль, відстань між атомами 0,1-0,2 нм.
Вторинна структура білків являє собою укладку поліпептидних ланцюгів в упорядковану форму за рахунок системи водневих зв’язків між – СО і –NH групами. Існує дві форми вторинної структури: α – спіраль (для уявлення – на циліндр намотана стрічка) і β– конформація (вигляд складчастого аркуша). Цю різновидність ще називають β – структура, β – складковий шар (або аркуш), шарувато-складкова структура.
Складкові структури зустрічають дуже часто: у колагенна, кератина, фіброїна шовку, трипсина, у глобулярних білків ці структури складають 15% і більше, у α – амілази до 30%. Можливі переходи від α - структур до β - структур і зворотньо.
Природних білків, які б складалися лише з α – спіралей, майже немає.
Сукупність α – спіралей і β – структур являється критерієм за яким можна судити за ступенем упорядкованості структури білкової молекули, її стабільністю при дії фізико-хімічних факторів.
Третинна структура – характеризується певною конформацією спіралізованих і лінійних ділянок поліпептидних ланцюгів у просторі.
Для кожного білка характерна своя третинна структура, від якої залежать його біологічні властивості.
Під час формування третинної структури поліпептидні ланцюги укладаються так, що максимальна кількість гідрофільних груп, залишків АК, була розміщена назовні, тобто повернута до водного середовища, а гідрофобні групи розміщуються всередині структури (глобули), яка має елипсоїдну форму. На конформацію глобули впливає рН середовища, іонна сила розчину, температура, взаємодія білкових молекул з іншими речовинами.
Порушення у вторинній структурі веде до підвищення гідрофобних взаємодій і підсиленню третинної структури. Вторинна структура порушується у точках, де знаходиться АК – пролін і гідросипролін, які утворюють тільки один водневий зв'язок з другими поліпептидними групами.
У цих точках ланцюг перегинається у трьохвимірному просторі. Таким чином між вторинною і третинною структурами виникає збалансоване співвідношення.
Одначе третинна структура не може існувати при зруйнованій вторинній структурі. В той же час біологічна функція білка залежить цілком від третинної структури. Її деформація чи руйнування призводять до часткової чи повної втрати цієї функції.
Четвертинна структура. Для білків, молекули яких побудовані з одного поліпептидного ланцюга, можливі лише первинна, вторинна і третинна структури. Четвертинна структура характерна лише для тих білків, які складаються з двох, чотирьох і більшої, в основному парної, кількості індивідуальних поліпептидних ланцюгів з власною третинною структурою. Такі поліпептидні ланцюги називаються протомерами, а білки, побудовані з них - олігомерами. Отже, взаємне просторове розміщення протомерів у білковій молекулі і становить її четвертинну структуру.
Вона лежить в основі будови білків – ферментів.
Четвертинна структура білків стабілізується і підтримується в нативному стані в основному за участю нековалентних зв’язків (водневих, іонних або гідрофобних).
При дії на білки з четвертинною структурою різних фізичних або хімічних факторів (органічні розчинники, сечовина, концентровані розчини солей, зміна рН тощо) вони можуть розпадатися на окремі протомери
Білки класифікують за фізико-хімічними властивостями та хімічним складом. За цими ознаками білки поділяють на дві групи – прості (протеїни) і складні (протеїди).
Протеїни – це білки, до складу яких входять лише залишки амінокислот.
Протеїди – складні білки, молекули яких крім залишків АК містять ще і інші компоненти – простетичні групи.
Прості білки(протеїни) поділяються на такі класи: - альбуміни, глобуліни, протаміни, гістони, проламіни, глутеліни і протеіноїди. Із названих білків детально зупинимося на чотирьох, які мають важливе значення у технологіях продуктів харчування: альбуміни, глобуліни, глутеліни і проламіни.
Альбуміни – входять до складу продуктів харчування: молока, яєць, зерна злакових і бобових культур.
Молекулярна маса альбумінів 35-70 тис. Молекули їх мають еліпсовидну форму, яка більш компактна і симетрична, ніж у глобулінів. Альбуміни належать до гідрофільних білків, вони добре розчиняються у воді. За хімічним складом альбуміни характеризуються високим вмістом лейцину (15%), а також значним вмістом сірковмісних амінокислот, лізину, аспарагінової і глутамінової кислот і незначним вмістом гліцину.
Глобуліни – входять до складу зерна злаків, насіння соняшника, льону, бавовника та бобових рослин. Широко відомі такі глобуліни, як фазеолін квасолі, легумін гороху, гліцидин сої. У тваринних тканинах найбільш розповсюдженими є лактоглобулін молока, фібриноген крові тощо.
Молекулярна маса глобулінів 0,9-1,5 млн. Вони більш грубодисперсні і менш гідрофільні, ніж альбуміни, що пояснюється меншою стійкістю їх колоїдних розчинів.
Добре розчиняються 10% розчинами солей. За хімічним складом глобуліни дещо відрізняються від альбумінів – містять більше гліцину (5%) і меншу кількість сірковмісних амінокислот.
Проламіни – ця група білків досить розповсюджена у рослинному світі. Вони входять до складу насіння злакових культур. Представниками їх є гліадин пшениці, орозеїн рису, гордеїн ячменю, зеїн кукурудзи, авенін вівса тощо. Назва «проламіни» була запропонована в зв’язку з тим, що до їх складу входить значна кількість проліну. Крім проліну проламіни містять також глутамінову кислоту і незначну кількість інших АК. Для проламінів характерним є те, що вони зовсім не містять лізину. Розчиняються у 70% водному розчині спирту.
Глутеліни як і проламіни, містяться у зелених частинах рослин і насінні. Характерною особливістю білків є те, що до їх складу входять велика кількість глутамінової кислоти і лізину. Добре розчиняються у лугах.
Складні білки (протеїди) складаються з простого білка і сполуки небілкової природи-простетичної групи (від грецького слова prosteto-приєдную, додаю). Залежно від хімічної природи простетичної групи складні білки поділяються на нуклеопротеїди, хромопротеїди, металопротеїди, глюкопротеїди, фосфопротеїди і ліпопротеїди.
Нуклеопротеїди – це складні білки, простетичною групою яких є нуклеїнові кислоти. Залежно від природи нуклеїнової кислоти нуклеопротеїди поділяються на рибонуклеопротеїди (РНП), якщо до їх складу входить рибонуклеїнова кислота – РНК, а якщо дезоксирибонуклеїнова кислота – ДНК.
Хромопротеїди – побудовані з простого білка і забарвленої простетичної групи якою можуть бути похідні каротину, порфірину (гемоглобін, міоглобін, ферменти). Гемоглобін крові – хромопротеїд, міоглобін міститься у м’язах тварин.
Глюкопротеїди – у складі простетичної групи містять залишки вуглеводів та їх похідні. Входять до складу крові, білків молока, яєць, ферментів, гормонів.
Металопротеїди – до складу простетичної групи входять залізо, мідь, кобальт, цинк та інші елементи. До металопротеїдів належить велика група ферментів.
Фосфопротеїди – містять у вигляді простетичної групи залишки ортофосфорної кислоти. Ці білки входять до складу білків яєць ( овальбумін), молока (казеїн).
Ліпопротеїди – у складі простетичної групи містять ліпіди і їх похідні (тригліцериди, фосфоліпіди, холестерин тощо). Найчастіше простетичною групою є нейтральні жири – тригліцериди. Входять до складу біологічних мембран, крові, лімфи, нервових тканин та інше.
В комплексі з білками ліпіди набувають нових властивостей: вони здатні розчинятися у воді і втрачають здатність розчинятися у органічних розчинниках. Ліпіди ж не розчиняються у воді і розчиняються у органічних розчинниках.
2. Функціональні властивості білків
Під функціональними властивостями мають на увазі властивості, які визначають їх зміни при переробленні у харчові продукти та забезпечують певну структуру, технологічні і споживні властивості. До найбільш важливих функціональних властивостей білків належать:
- водозвязувальна;
- жирозвязувальна;
- структуроутворювальна (піноутворювальна та драглеутворювальна) здатність.
Здатність білків зв’язувати на своїй контактній поверхні воду – одна із характерних фізико-хімічних властивостей що відіграє важливу роль у технології харчових продуктів.
З гідрофільністю пов’язані такі процеси, як набухання і розчинність білків, їх осадження і денатурація при дії жорстких фізико-хімічних факторів середовища.
Гідрофільність являє собою наслідок дії електростатичних сил протягування, що розвиваються між іоногенними і полярними групами білкової глобули і диполями води.
Набухання. Внаслідок великої різниці у швидкості дифузії молекул білків і низькомолекулярного (вода) розчинника на першій стадії процесу розчинення білка молекули розчинника проникають у простір між полімерними ланцюгами білка. Відбувається збільшення об’єму молекули. Це явище називають набуханням, яке переходить у розчинення (необмежене набухання) у тому випадку, коли між поліпептидними ланцюгами відсутні поперечні хімічні зв’язки. Це явище характерне для глобулярних білків. У поліпептидах, що утворюють сітчасту структуру, розчинення неможливе, і процес закінчується набуханням (обмежене набухання). Такі перетворення характерні для деяких фібрілярних білків.
Кількісною характеристикою обмеженого набухання є ступінь набухання αm, яку визначають гравіметричним способом: зважують зразок до і після набухання і розраховують за формулою:
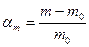
m – маса набухлого зразка;
m0 – наважка вихідного зразка.
Ступінь набухання також визначають об’ємним методом, вимірюючи об’єм зразка до і після набухання:

V – об’єм набухлого зразка;
V0 – об’єм вихідного зразка.
Ступінь набухання залежить від різних факторів, у тому числі від природи розчинника.
Розчинення білків – спонтанний процес.
Таким чином, при постійному тиску і температурі він супроводжується зменшенням вільної енергії (енергії Гіббса):
DG = DH - TDS, де
DG – ентальпія; DS – ентропія; Т – температура.
При обводненні системи на стадії набухання і розчинення білків зміни вільної енергії перевищують зміни вмісту тепла і ентропія системи починає зростати.
Під дією електростатичних сил поверхня білкової глобули покривається гідратною оболонкою. Перший шар молекул води (мономолекулярний шар) досить міцно адсорбований на поверхні, наступні шари гідратної оболонки, по мірі того як електростатичні сили слабкішають, стають менш упорядкованими.
Виникає ситуація коли характерною ознакою якої є повільний перехід від твердої фази (білкової глобули) до дисперсійного середовища (вода); білкова глобула як би закріплена на "якорях", роль яких виконують диполі води. Оскільки диелектрична проникність води висока, взаємозв’язок між білковою глобулою і водним середовищем досить стабільний.
При контакті з водою сухий білок набухає, молекули води проникають у білкову масу і в результаті гідратації молекули білка роз’єднуються.
Важливу роль тут відіграють не тільки електростатичні сили, але і сили осмосу.
Набухлий білок можна вважати розчином води у білку; енергія набухання велика. Подальше поглинання води призводить до розчинення білка.
Розчинення пов’язано з хімічною структурою білка. Оскільки амінокислотний склад білків різний, розчинність білків коливається у широких межах і буде визначатись співвідношенням гідрофільних (іоногенних і полярних) і гідрофобних (неполярних) R – груп, специфікою укладання їх у трьохвимірну структуру; чим більше гідрофільних R – груп на поверхні білкової молекули, тим вища її гідрофільність і тим вища розчинність білка; поверхневі гідрофобні R – групи зменшують розчинність.
Глобулярні білки краще розчинні, ніж фібрілярні. Кількість зв’язаної води для різних білків складає біля 0,15-0,35 г на 1 г білка.
Явище набухання широко розповсюджено у харчових технологіях; воно, наприклад, відіграє важливу роль в утворенні пшеничного тіста.
Набухлі білки борошна гліадин і глютенін відомі під назвою клейковина, яка обумовлює пружність, розтяжність і еластичність тіста.
Обмежено набухає колаген – основний компонент сировини і напівфабрикатів м’ясної промисловості.
Частково деструктурований колаген називають желатином, який легко набухає у теплій воді.
При набуханні об’єм і маса зразків збільшується у 10-15 разів.
Якщо набухання переходить у розчинення (необмежене набухання) система переходить у стан геля (студня).
На процес набухання впливає ряд факторів:
1. Додавання електролітів, які гальмують набухання;
2. Швидкість набухання зростає з підвищенням температури;
3. Швидкість і ступінь набухання зростають із збільшенням ступеня подрібненості полімеру, оскільки зростає поверхня контакту полімеру з розчинником і інтенсивність дифузії молекул. Ці фактори мають важливе значення у харчових технологіях.
Вплив електростатичних сил на розчинність білків залежить від рН середовища. Білки є амфотерними електролітами, оскільки вони містять карбоксильні і амінні групи та можуть дисоціювати і як кислоти, і як луги. Але при рН, близьким до ізоелектричної точки, розчинність білків найменша. В ізоелектричній точці спостерігається також найменша в’язкість розчинів білків та найлегше білки осідають з розчинів.
Але сам по собі білок не виділяється у вигляді осаду. Це можна зробити за допомогою нейтральних солей у високих концентраціях (сульфат амонію, фосфат натрію або калію) або органічних розчинників (спирту, ацетону). Процес вилучення білка з розчину під дією солей називається висолюванням. Насичення водного розчину спиртом або ацетоном призводить до зневоднення білків, оскільки спирт та ацетон є більш гідрофільними, порівняно з білками. Внаслідок цього білкові глобули злипаються у крупніші частинки і випадають в осад.
Ця властивість використовується у технологіях виготовлення ізолятів та концентратів білків. Суть технології полягає у переведенні білків сировини (соєвих білків, соняшникових та інших) у розчин за допомогою кислот чи лугів, а потім – виділення цих білків з розчинів осадженням. Осадження білків краще відбувається при низьких температурах.
Висолювання є зворотнім процесом. Після видалення осаду білки знову можна розчинити. Розчини білків є колоїдними розчинами.
Денатурація білків
Нативна (природня) конформація глобулярного білка, піддається змінам під дією жорстких фізико-хімічних факторів середовища. Ці зміни одержали назву – денатурація (зворачування) білка.
Денатурація – це наслідок руйнування нативної структури білків, який супроводжується втратою біологічної активності (ферментативної, гормональної).
З фізичної точки зору – це деструкція білкової молекули без зміни первинної структури (руйнуються вторинна, третинна і четвертинна структури).
Типовим прикладом денатурації є згортання (зкручування) яєчного альбуміну при варінні яєць.
При денатурації поліпептидний ланцюг звертається і перетворюється в безпорядний, хаотичний клубок.
Фактори, що викликають денатурацію білків, можна поділити на фізичні і хімічні.
До фізичних відносяться: нагрівання, механічне перемішування, ультразвук, ультрафіолетові і іонізуючі промені.
До хімічних – кислоти, луги, солі важких металів (Ag, Pb, Hg), сечовина, таннін, трихлороцтова кислота, гуанідин.
Теплова денатурація є одним із характерних ознак білків, але для різних білків температурна денатурація різна. Білки тваринного походження термолабільні: їх денатурація починається уже при 400С і швидко зростає з підвищенням температури. Але відомі білки які стійкі до нагрівання, наприклад трипсин, хімотрипсин, a - лактоглобулін молока, a - амілаза деяких бактерій.
Сухі білки більш стійкі до теплової денатурації, ніж білки у розчині. По тій причині концентровані розчини білків більш стійкі у порівнянні з розбавленими розчинами білків.
Часто теплову денатурацію білків ототожнюють з їх коагуляцією. Але ці два процеси суттєво відрізняються за своєю фізико-хімічною суттю. Теплова денатурація білків є причиною їх агрегації і коагуляції (випадання в осад). Однак денатурація не завжди призводить до коагуляції. Денатурований білок при певних умовах може залишатися в розчині.
Наприклад, при нагріванні розчину білка з рН, далеким від ІЕТ, до 1000С білок не завжди коагулює і випадає в осад.
Денатурація виникає при механічному перемішуванні, сильному струшуванні білкових розчинів.
Білки відносяться до поверхнево-активних речовин. При механічному впливу у розчині білка утворюється піна, на поверхні бульбашок якої і розвивається процес денатурації.
Ультразвукові хвилі викликають денатурацію за рахунок як механічного впливу, так і теплових ефектів.
Ефективними хімічними агентами денатурації білків є кислоти і луги. Багато білків денатурують при значеннях рН нижче 2 або вище 12.
Солі важких металів, трихлороцтова кислота, танін навіть у невеликих концентраціях викликають денатурацію білків, утворюючи з ними нерозчинні комплекси.
Деякі хімічні сполуки справляють на білки захисні дії. Так, денатурація гальмується концентрованими розчинами гліцерину, глюкози і інших цукрів, що пов’язано, очевидно, з їх адсорбцією на глобулах білків і утворенням великих гідрофільних комплексів.
Найбільш типовими ознаками денатурації є такі:
1. Зниження гідрофільності і розчинності білків, внаслідок чого зменшується стійкість їх розчинів.
2. Збільшення в’язкості розчинів. Білки втрачають здатність до кристалізації.
3. Зменшення молекулярної маси і зміна форми білка.
4. Молекула переходить у хаотичний стан – поліпептидні ланцюги спочатку розгортаються, проходячи стадію нитки, а потім знову згортаються, але вже по-іншому, тобто проходить зміна конформації молекули білка. При цьому збільшується здатність білка до розщеплення їх ферментами.
Необхідно зазначити, що денатурація не завжди є необоротним процесом. При недовготривалій дії денатуруючого агента білок можна повернути в попередній, нативний стан. Цей процес має назву ренатурації, або пептизації.
Характерним для цього процесу є те, що при ренатурації відновлюється фізіологічна активність білків – ферментів. При ренатурації білків ніяких нових зв’язків і нових властивостей, не властивих нативному білку, не виникає, а відновлюються лише ті, які були для нього характерними.
Процеси денатурації білків відіграють велику роль у технологічних процесах харчових продуктів при їх тепловій обробці. Формування м’якушки хліба, варка сусла з хмелем, бланшування плодів і овочів крутим кип’ятком чи гострою парою, кипятіння молока, кулінарна обробка м’ясних і рибних продуктів зв’язані з денатурацією білка.
3.Перетворення білків у харчових технологіях
Будь які зміни умов середовища в технологічних процесах виробництва харчових продуктів впливають на нековалентні зв’язки макромолекул білка і призводять до змін четвертинної, третинної і вторинної структур. Під дією технологічних факторів білки можуть утворювати ізоляти та приймати участь в реакціях, зокрема біохімічних.
Основні перетворення білків полягають у їх денатурації, гідролізі, утворенні токсичних елементів тощо.
Процес денатурації білків викладено у попередньому розділі.
Термічна обробка білків при температурах 40-1000С призводить не лише до денатурації, а й прискорює небажані термічні перетворення які були розглянуті раніше.
Термічна обробка білоквмісних продуктів при температурі 100-1200С призводить до руйнування макромолекул білка з розщепленням пептидних зв’язків і утворенням Н2S (сірководень), NH2 (аміак), СО2, диметилсульфіда Н3С – S – CH3 та інших сполук небілкової природи.
Так, стерилізація молочних продуктів при температурі вище 1150С викликає руйнування цистеінових залишків з відщеплюванням сірководню, диметилсульфіда і цистеінової кислоти.
Серед продуктів розщеплення білків зустрічаються сполуки, що надають їм мутагенні властивості.
Мутагени утворюються при обсмажуванні в маслі, коптінні у диму і сушці. Вони містяться в бульйонах, смаженій говядині і свинині, домашній птиці, смажених яйцях, копченій і в’яленій рибі. Деякі із них викликають спадкові зміни в ДНК, і їх вплив на здоров’я людини може бути від незначного до летального.
Токсичні сполуки білків утворюються при термічній обробці вище 2000С за рахунок реакції ізомеризації амінокислот із L-форми в D-форму. Такі перетворення можливі при нижчих температурах, але в лужному середовищі.
Руйнування природних білково-ліпідних комплексів також є небажаними, оскільки ліпіди, що звільняються, можуть піддаватися окисленню і здатності ініціювати окисні ланцюгові реакції білків, які призводять до зменшення амінокислот.
Гідроліз. Білки піддаються хімічному (під дією кислот і лугів) та біохімічному (ферментативному) гідролізу.
Кислотний та лужний гідролізи здійснюють при кипятінні з міцними кислотами та лугами. Кислотний та лужний гідроліз застосовується у технологіях отримання білкових концентратів та ізолятів для переведення білків у розчинений стан з наступним виділенням білків із розчину шляхом висолювання.
Ферментативний гідроліз здійснюється під дією протеаз, ферментів, які гідролізують пептидні звязкі, з утворенням більш дрібних фрагментів і амінокислот.
4.Значення білків у життєдіяльності людини
Окремо взятий білок, як речовина з визначеною хімічною будовою, виконує одну вузькоспеціалізовану функцію і в окремих випадках декілька, як правило взаємопов'язаних. Та чи інша молекула білка має строго визначений генетично закодований амінокислотний склад, специфічні фізико-хімічні властивості, специфічну біологічну функцію у живій клітині, що обумовлює цільове призначення білка.
Строга специфічність біологічних функцій білків – основа обміну речовин у живій клітині. Ні один клас біологічно-активних речовин не наділений такими властивостями, як білки. Ні одна біологічна реакція в організмі людини не протікає без прямої чи побічної участі білків.
Постільки обмін речовин в організмі людини являє собою сукупність великого числа біохімічних реакцій, в яких безпосередньо приймають участь білки, важко дати вичерпний опис усіх біологічних функцій. Перерахуємо лише головні із них.
1. Ферментативна (каталітична) функція. Без неї не протікає ні одна біохімічна реакція у живій клітині. Ферменти – функціональний тип білків. Синтез і розкладання речовин, регуляція хімічних процесів, перенесення хімічних груп і електронів від одної речовини до іншої здійснюється за допомогою цих специфічних білків. На сьогодні відкрито біля 3 тисяч різних ферментів, кожний із яких служить каталізатором певної хімічної реакції.
На прикладі ферментів ми переконуємося на скільки багатосторонні специфічні біологічні функції білків. α-амілаза, наприклад, гідролізує крохмаль (найважливіша реакція у харчовій технології); пепсин (важливий фермент харчотравлення) гідролізує білки; цитохромоксидаза (важливий фермент біоенергетики живої клітини) переносить електрони на кисень; амінотрансфераза (важливий фермент в обміні білків) переносить аміногрупу від однієї речовини до іншої.
2. Гормональна функція. Забезпечує регулювання обміну речовин в середині клітини і інтеграцію обміну речовин різних клітин цілого організму, наприклад, гормон інсулін регулює вуглеводний, білковий, жировий обміни.
3. Транспортна функція. Здійснює зв’язування і транспорт речовин між тканинами через мембрани. До таких білків відносяться ліпопротеїни, які переносять кисень у м’язові тканини; гемоглобін (джерело вільної хімічної енергії), зв’язує кисень повітря при проходженні його через легені і доставляє його до периферійних тканин, де відбувається окислення компонентів їжі; пермеази, зв’язують глюкозу, амінокислоти і інші харчові речовини і переносять їх через мембрани в середину клітини.
4. Хіміко-механічна (скорочувальна) функція. Білки перетворюють вільну хімічну енергію в механічну роботу. До цих білків відносяться білки м’язових тканин: міозин, що закріплений у нитках м’язових волокон – міофібриллах, і актин, який міститься у рухливих міофібриллах.
5. Структурна функція. Цю функцію виконують білки, які беруть участь у будові різних мембран (плазматичних, мітохондріальних). До них відносяться також білки, які забезпечують міцність опорних тканин: колаген – структурний елемент опорного каркаса кісткової тканини, хрящів, сухожиль – має дуже високу міцність на розрив; кератин – структурна основа шерсті, волосся, перин, копит, рогів; еластин – білок здатний розтягуватися у двох вимірах.
6. Захисна функція. Захисні реакції організму пов’язані з білками: зокрема антитіла, які утворюються під час надходження в організм сторонніх речовин, є білки. Ці сполуки утворюють із токсинами малоактивні комплекси, які виводяться із організму, отже виконують антитоксичну функцію.
7. Резервна функція. Використання білків у якості запасних матеріалів для живлення клітин, що розвиваються. До них відносяться проламіни, глютеліни - білки хлібних культур; альбумін – яєчний білок, що використовується для розвитку зародка; казеїн молока – білок, що використовується для годування новонароджених ссавців.
Резервні білки є найважливішими компонентами рослинної і тваринної їжі.
8. Спеціальні функція. Серед білків зі спеціальними функціями слід виділити рецепторні білки, які забезпечують передачу імпульсів між нервовими клітинами і передачу сприйняття світла; білки, що уберігають кров риб, що перебувають у холодних водах, від замерзання.
9. Енергетична. При дефіциті вуглеводів і жирів у раціоні білка є джерелом енергії. При окисненні 1 г білка виділяється 4 ккал тепла.
5. Методи визначення білків
Якісні реакції на білки
Дуже важливою властивістю білків є забарвлюючі їх реакції, які зумовлені наявністю в білковій молекулі певних хімічних груп. До них відносяться ксантопротеїнова, біуретова, Міллонова реакція, реакція Адамкевича.
Ксантопротеїнова реакція полягає в тому, що при обробленні білка міцною азотною кислотою з’являється жовте забарвлення, зумовлене наявністю в білку бензольних кілець.
Міллонова реакція полягає в обробленні білка міллоновим реактивом (розведеним водою розчином металевої ртуті в азотній кислоті), який реагує з фенольними групами, утворюючи сполуки, що надають білку вишневого-червоного забарвлення.
Біуретова реакція – поява фіолетового чи червоно-фіолетового забарвлення під дією розчину CuSO4 у лужному середовищі.
Реакція Адамкевича – поява фіолетового забарвлення при додаванні до розчину білка декількох крапель гліоксилевої кислоти та міцної сірчаної кислоти. Ця реакція залежить від наявності індолевої групи.
Кількісне визначення білків
1. Визначення азоту за методом Кєльдаля основано на повному руйнуванні білка під дією сірчаної кислоти у присутності каталізатора. Азот білка уловлюється у формі сульфату амонію і визначається у вигляді аміаку після перегонки з парою гідролізату, підлуженого додаванням концентрованого NaOH. Аміак зазвичай аналізується оберненим титруванням після поглинання у кислотних ловушках.
2. Колориметричні методи.
Біуретовий метод оснований на специфічній реакції пептидних зв’язків з іонами міді у лужному середовищі. Методика проста, але малочутлива.
Метод Лоурі. В основі метода лежить реакція відновлення реактиву Фоліна мідним похідним білка з утворенням забарвлених продуктів реакції. Інтенсивність забарвлення вимірюють за допомогою фотоелектроколориметра.
3. Сучасні методи визначення вмісту білків базуються на використанні амінокислотних аналізаторів за допомогою яких визначається як загальний вміст білка, так і його амінокислотний склад.
Питання для самоперевірки
1. Дайте визначення білків.
2. Охарактеризуйте елементний склад білків.
3. Що таке пептидний зв'язок?
4. Які функціональні групи входять до складу амінокислот? Що таке амфотерність амінокислот?
5. На основі яких принципів класифікують амінокислоти?
6. Що таке «ідеальний білок»?
7. Як визначається амінокислотне число (скор)?
8. Як впливає рН середовища на іонізацію АК?
9. Що таке ізоелектрична точка?
10. Поясніть, що таке реакція Майяра?
11. Як класифікують білки за просторовою структурою?
12. Охарактеризуйте первинну і вторинну структури білка.
13. Охарактеризуйте третинну і четвертинну структури білка.
14. Як класифікують білки за фізико-хімічними властивостями?
15. Охарактеризуйте групи протеїнів, що розчиняються у воді і солях.
16. Дайте характеристику проламінами і глутелінам.
17. Охарактеризуйте складні білки.
18. Що таке функціональні властивості білків?
19. Поясніть суть набухання білків і їх розчинності?
20. Перерахуйте фактори, що впливають на процес набухання білків?
21. Що таке денатурація білків? Фактори що їх викликають?
22. Охарактеризуйте теплову денатурацію білків.
23. Хімічні фактори, що викликають денатурацію.
24. Які типові ознаки денатурації білків Ви знаєте?
25. Які зміни відбуваються під час термічної обробки білків?
26. Як відбувається ферментативний і кислотний гідроліз білків?
27. Наведіть основні функції білків в організмі.
28. Які забарвлюючі реакції визначення білків Ви знаєте?
29. Які методи кількісного визначення білків Вам відомі?
Рекомендована література
Основна:
1. с. 17 – 112
2. с. 14 – 88; с. 181 – 201; с. 349 – 399.
3. с.51 - 53
4. с. 8-12
Додаткова:
1. с. 55 – 67
4.с. 88 - 100
Вуглеводи. Будова, властивості, перетворення в
харчових технологіях
1. Будова вуглеводів, класифікація, властивості
2. Перетворення вуглеводів при виробництві харчових продуктів
3. Функціональні властивості вуглеводів
4. Роль вуглеводів в організмі людини
1. Будова вуглеводів, класифікація, властивості
Вуглеводи є невід'ємною складовою частиною всіх клітин і тканин живих організмів. На долю вуглеводів приходиться 60-70% харчового раціону. Вони містяться переважно у рослинних продуктах.
В організмі людини і тварин вуглеводи виконують енергетичну, структурну і захисну функцію.
Термін "вуглеводи" вперше був запропонований у 1844р. К.Ш.Шмідтом, професором Юрьївського університету. Ці речовини формально за складом можна розглядати як сполуки вуглецю з водою Сn (Н2О)m. Але у зв'язку з подальшими відкриттями – дезоксіцукрів і ряду інших вуглеводів (рамноза С6Н12О6), формули яких не відповідають подібному співвідношенню, термін "вуглеводи" втратив своє обґрунтування, але зберігався як історично склавшийся.
Вуглеводи ще часто називають цукрами.
Вуглеводи у відповідності з особливостями їх будови і властивостями, зокрема, за здатністю гідролізуватися з утворенням різного числа мономерів, поділяють на:
1. Моносахариди (монози, прості цукри). До них відносяться вуглеводи, які не гідролізуються з утворенням більш простих цукрів.
2. Олігосахариди (цукроподібні полісахариди) – сполуки, що гідролізуються з утворенням невеликої кількості (2-10) простих цукрів.
3. Полісахариди (нецукроподібні полісахариди) – сполуки, що гідролізуються з утворенням більшої кількості цукрів.
Схема класифікації вуглеводів

1. Моносахариди. Їм відповідає загальна формула CnH2nOn, де n = 4,5,6,7,8 і т.д.
Залежно від числа атомів вуглецю у ланцюгу моносахариди розрізняють:
триози, сполуки, що містять 3 вуглецевих атома;
тетрози, сполуки що містять 4 вуглецевих атома;
пентози, сполуки, що містять 5 вуглецевих атома;
гексози, сполуки, що містять 6 вуглецевих атома;
гептози, сполуки, що містять 7 вуглецевих атомів.
і т. д.
|
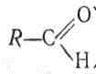
За наявності альдегідних або кетонних груп моносахариди поділяють на альдози і кетози

|
альдегідна кетонна
Звідси і назви:
триози – альдози (альдотриози) або кетози (кетотрози)
тетрози – альдози (альдотетрози) або кетози (кетотетрози)
пентози – альдози (альдопентози) або кетози (кетопентози)
гексози – альдози ( альдогексози) або кетози ( кетогексози)
Більшість моносахаридів мають прямий вуглецевий ланцюг. Але є моносахариди з розгалуженим ланцюгом (апіоза – міститься у петрушці, стрептоза – міститься у стрептоміцині).
Крім гідроксильних, альдегідних і кетонних груп моносахариди містять амінні, карбоксильні і сульфігідрильні групи.
Число гідроксильних груп інколи не відповідає кількості вуглецевих атомів. Такі моносахариди називають дезоксисахарами.
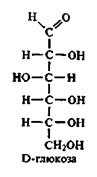
Центральне місце серед моносахаридів займає гексоза – глюкоза. Тому особливості будови альдоз розглянемо на прикладі глюкози.
Молекула глюкози містить шість вуглецевих атомів. Її елементарна формула С6Н12О6.
Глюкоза в структурі молекули має альдегідну групу і веде себе як альдегід.
Нумерація вуглецевих атомів у ланцюгу починається від кінцевого карбонільного вуглецю.
Приведена формула глюкози називається ациклічною.
Молекули моносахаридів містять асиметричні вуглецеві атоми. В триозі він-один, в тетрозах-два, в пентозах – три, в гексозах – чотири. Ці атоми зв'язані з чотирма різними атомами і групами атомів. Тому можливе різне взаємне просторове розташування замісників біля асиметричних атомів вуглецю в молекулах моносахаридів і існування просторових ізомерів.
Кількість стереоізомерів кожного моносахарида обумовлено кількістю асиметричних атомів і розраховується за формулою:
N = 2n, де
N –число ізомерів;
n – кількість асиметричних вуглецевих атомів;
Користуючись цією формулою розраховуємо число ізомерів для альдоз.
Для триоз воно – 2, тетроз – 4, пентоз – 8, гексоз – 16.
У розчинах моносахариди перебувають одночасно в ациклічній (ланцюговій) і циклічній формах з шестичленним (піранозним) або пятичленним (фуранозним) кільцем. Обидві форми є структурними ізомерами – таутомератми, оскільки перебувають у стані рівноваги:

|
Рівновага сильно зміщена в бік циклічної форми, у вигляді якої моносахариди вступають у реакції конденсації при утворенні полісахаридів, нуклеїнових кислот, глюкозидів та інших сполук. У кристалічному стані моносахариди мають циклічну форму.
Циклічна форма утворюється внаслідок переміщення водню від гідроксильної групи у четвертого чи п'ятого атома вуглецю до карбонільної; з'являється кільце і гідроксильна група у першого вуглецевого атома.
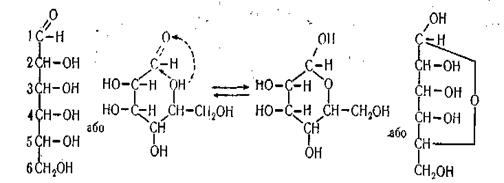
|
а група – ОН біля С1 – напівацитальним гідроксилом, який має підвищену хімічну активність.
|
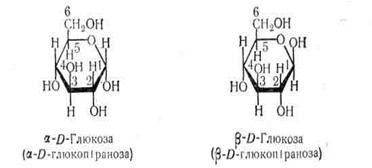
Проекційні формули Фішера Е, Коллі О., Толленса Б. не дають повного уявлення про просторове розміщення всіх частин молекули моносахарида. Щоб передати просторову конфігурацію моносахариду ангілійський дослідник Н.Хеуорс запропонував для циклічних структур моносахаридів перспективні формули. В них атоми і атомні групи, розміщені в проекційних формулах праворуч, зображають знизу площини кільця, а розміщені ліворуч, - зверху площини кільця. Атоми, що утворююють кільце, часто не пишуть, Хеуорс запропонував називати моносахариди з шестичленним кільцем піранозами, а з пятичленним фуранозами (назви походять від назв кисневмісних

|
гетероциклічних сполук – фурану і пірану) з префіксом від назви моносахариду.
Це пояснюється тим, що для утворення кисневого містка необхідний поворот частини молекули навколо валентної осі, що з’єднує 4 і5 атоми вуглецю. Після такого повороту гідроксил з 5-го атому вуглецю займає положення, яке є благо-приємним для замикання кільця.
При замиканні цикла карбонільний вуглець стає асиметричним, що призводить до утворення двох нових стереоізомерів, які називають a і b - аномерами.
Глюкоза, гексоза, дестроза, виноградний цукор – такі назви має цей цукор. З неї побудований крохмаль, глікоген, мальтоза, входить до складу сахарози і лактози.
Температура плавлення 1460С. Зброджується дріджами. Організмом людини легко засвоюється. Це висококалорійний харчовий продукт, який швидко відновлює енергію організму.
Використовують глюкозу у виробництві морозива, згущеного молока, консервів, в кондитерському виробництві. Використовується для синтезу аскорбінової кислоти, сорбіта і інших продуктів.
Фруктоза, плодовий сахар, левулеза, Д – арабіногексулоза. Входить до складу плодів, меду, бере участь у будові рослинних полісахаридів – фруктанів і олігоцукридів. Плавиться при температурі 1000С, вона менш стійка до температур, дії кислот, лугів, швидко піддається деструкції, наприклад при нагріванні з розчинами кислот.
В промисловості фруктозу одержують гідролізом сахарози чи фруктанів, що є в топінамбурі.
Фруктоза використовується для заміни сахарози, запобігає зацукрюванню варення, для подовження термінів зберігання булочних виробів. В організмі людини перетворюється у глюкозу.
Галактоза, цереброза. Зустрічається як у вільному вигляді так і в складі олігосахаридів (галактани, камеді і слизі). Плавиться при 1690С. Відновлює реактив Фелінга, трудніше, ніж глюкоза і маноза зброджується дріджами.
Одержують гідролізом лактози чи галактанів, що містяться у деревині, водоростях.
Ксилоза, пентоза (С5Н8О4)n – є складовою багатьох рослинних полісахаридів – пентозанів. Температура плавлення 1450С. Добре розчинна у воді.
При відновленні ксилози одержують ксиліт. Засвоюється деякими видами дріжджів.
Одержують ксилозу нагріванням геміцелюлоз які є у кукурудзі, соняшнику, бавовнику.
Використовують для одержання кормових дріжджів.
Арабіноза у природі зустрічається рідко.
Вона входить до складу глікозидів, олігосахаридів, полісахаридів (камеді, слизі, арабаногалатани).
Це тверда кристалічна речовина, розчинна у воді. Температура плавлення 1580С. При окисленні дає арабанову кислоту, при відновленні - спирт арабіт.
Олігосахариди
Вуглеводи, молекули яких утворюються із двох – шести залишків моносахаридів, які зв'язані між собою глікозидними зв'язками. Це кристалічні, добре розчинні у воді, солодкі на смак речовини.
Серед олігосахаридів найбільше значення мають дисахариди, молекули яких побудовані із двох молекул моносахаридів.
Дисахариди
Сахароза (цукроза) буряковий або тростинний цукор. Складається із залишків глюкози і фруктози. Це невідновлюючий цукор, біла кристалічна речовина, добре розчинна у воді. Під впливом слабких кислот або ферментів відбувається гідроліз сахарози який дістав назву інверсії (повертання), а суміш однакових кількостей глюкози і фруктози, що утворилися після гідролізу – інвертним цукром. Міститься у цукровому буряку до 27%, стеблах сорго і соці цукрової тростини 14-26%. Це запасний вуглевод багатьох рослин. Плавиться при 1700С. При нагріванні сахароза буріє з виділенням води, утворюючи карамель.
Мальтоза або солодовий цукор. Це продукт неповного гідролізу крохмалю, що відбувається під дією амілаз. В результаті гідролізу утворюються дві молекули глюкози.
Має відновні властивості, плавиться при 1020 – 1030С, менш солодка ніж сахароза.
В промислових маштабах виробляється у вигляді патоки, яку одержують із крохмалю шляхом його гідролізу.
Патоку використовують у кондитерській, хлібопекарській промисловості, для виробництва консервів, варення, джемів і т.д.
Лактоза, молочний цукор. Міститься у молоці до 4-5,5%. Лактоза мало гідроскопічна, менш солодка ніж цукор. Використовується у фармацевтичній промисловості для виготовлення ліків.
Трегалоза зустрічається у грибах, (її називають грибним цукром), а також у синьо-зелених морських водоростях. Її багато (до 18% сухої маси) у хлібопекарських дріджах. Не відновлює реактив Фелінга.
Три - , тетра – і пентасахариди
Рафіноза. Невідновлюючий цукор.
Міститься у коренях цукрового буряка в кількості 0,2 – 1,0% у перерахунку на цукрозу. Складається із галактози, глюкози і фруктози.
Стахіоза, тетрасахарид містить рафінозу плюс галактозу.
Вербіоза, пентасахарид це стахіоза плюс галактоза.
Ці олігосахариди виявлені головним чином у насінні бобових: сої, чечевиці, люцерні у виці. Вважають, що вони можуть визивати у людини метиоризм.
Полісахариди
Полісахаридами називають високомолекулярні продукти поліконденсації моносахаридів, зв'язаних між собою глікозидними зв'язками, утворюючи лінійні чи розгалужені ланцюги.
Вони можуть бути побудовані із одного чи декількох видів моносахаридів.
В залежності від цього розрізняють гомо – і гетерополісахариди.
Класифікація полісахаридів
| 1. Глюкани: | амілоза, амілопектин, глікоген, целюлоза, і інші |
| 2. Манани: | манани, глюкоманани, галактоманани, глюкурономанани, галактоглюкоманани |
| 3. Галактани: | галактани, арабіногалактани, сульфіровані галактани |
| 4. Фруктани: | інулін |
| 5. Ксилани: | ксилани, арабіноксилани, глюкуроноксилани, арабіноглюуроноксилани |
| 6. Арабінани | |
| 7. Поліуроніди: | галактуронани – пектинові речовини, мануронани – альгінова кислота |
Крохмаль – резервний полісахарид формули (С6Н10О5)n. У великих кількостях міститься у ендоспермі зерна пшениці 58-78%, кукурудзи -65-72%, рису 62-85%, картоплі до 30% і інших.
Це біла аморфна речовина, що набухає у гарячій воді з утворенням колоїдного розчину, який при охолодженні перетворюється у клейстер. З розчином йоду дає темно-синє забарвлення.
Розмір крохмального зерна коливається від 2 до 150 мкм.
Крохмаль складається із залишків глюкози і містить два полісахариди: амілозу (25%) і амілопектин (75%).
Амілоза має лінійну, нерозгалужену будову, кожна молекула якої містить від 100 до 2000 залишків глюкози. Її молекулярна маса 16000 – 324000 і більше.
Амілопектин – має розгалужену молекулу яка залежить від виду крохмалю. Середня довжина ланцюга складає 18-24 моносахаридних залишки. Молекулярна маса досягає декілька мільйонів одиниць.
Декстрини– це полісахариди з меншою молекулярною масою, ніж у крохмалю, добре розчиняються у воді, мають відновні властивості і дають забарвлення з розчином йоду.
Крохмаль не розчиняється у спирті, ефірі, хлороформі, бензолі. Частково розчиняється у лугах і розчинах солей ( Ca Cl2, солі цинка, магнія і інших металів).
Температура клейстеризації крохмалю 55-750С в залежності від властивостей вихідного зерна.
Ферменти, що розщеплюють крохмаль, називаються амілазами. Є a - і b - амілази.
a - амілаза (декстриногенна) при каталізі утворює декстрини і мальтозу. Вона здатна перетворити у мальтозу 80-82% крохмалю, швидко гідролізує крохмальний клейстер, на нативний крохмаль не діє.
b - амілаза (сахарогенна, або мальтогенна) гідролізує полісахарид на мальтозу.
Крохмаль широко використовується у харчових технологіях: кондитерській, хлібопекарській, м'ясній, харчоконцентратній.
Із крохмалю одержують спирт, глюкозу, декстрини, патоку.
Використовують крохмаль для приготування киселів, пудингів, соусів і інших блюд.
Глікоген, або тваринний крохмаль (С6Н10О5)n. Це білий аморфний порошок який є запасним енергетичним матеріалом у організмі тварини і людини. Глікоген, як і крохмаль, побудований із залишків глюкози; будова схожа з амілопектином, легко розчиняється у воді без утворення клейстеру. Колоїдний розчин не відновлює реактив Фелінга, дає з йодом від червоного до червоно-бурого забарвлення, яке втрачається при нагріванні і з'являється при охолодженні.
Глікоген міститься також у кукурудзі; молекула рослинного глікогену більш розгалужена, ніж амілопектину; він є у дріжджах і грибах.
В організмі людини всі процеси життєдіяльності, в першу чергу робота м'язів, проходять з розщепленням глікогену. Особливо багато глікогену у печінці (2-5%), м'язах (0,2-2%). В організмі людини синтезується із глюкози і відкладається в органах і тканинах, а в період між прийманням їжі розщеплюється і постачає організм глюкозою.
Целюлоза або клітковина (С6Н10О5)n – основна частина клітинних стінок. Це високомолекулярний лінійний полісахарид, що складається із залишків глюкози. Молекулярна маса 250,000 – 2.000.000. Ниткоподібні молекули целюлози, орієнтуючись паралельно одна одній, укладаються у пучки, де між ними виникають водневі зв'язки в результаті взаємодії гідроксильних груп. Певна кількість пучків з'єднуються у волокна. Ці особливості будови і є причиною нерозчинності целюлози у воді і органічних розчинниках (розчинник не може проникнути в середину пучка) та механічної міцності її волокон. Розчиняє целюлозу аміачний розчин гідроксиду міді(ІІ) (реактив Швейцера), концентрована сірчана кислота перетворює целюлозу в амілоїд (частково гідролізована целюлоза), що використовується при виготовленні пергаментного паперу.
Целюлоза майже не проявляє відновних властивостей.
Багаті целюлозою волокна бавовника, де її вміст складає 95-98%, у волокнах льону, джута, у деревині до 50% целюлози.
Целюлоза майже не засвоюється організмом людини, але засвоюється травоїдними.
За останні часи значно виросла цікавість до целюлози як до фізіологічно активної добавки в їжу із-за її здатності стимулювати моторику кишечника, адсорбувати хімічні токсиканти і радіонукліди.
Декстрани – це нейтральні гомополісахариди які складаються із залишків глюкози. Ці сполуки утворюють розчини надзвичайної в'язкості. Молекули декстранів сильно розгалужені.
Декстрани синтезуються із сахарози слизеутворючими бактеріями. Вони не входять до складу харчових продуктів, але є причиною їх ослизнення в процесі зберігання. При цьому декстрани відкладаються на поверхні бактеріальної клітини, утворюючи захисний шар – капсулу, у десятки разів перевищуючи розміри самої бактеріальної клітини.
Бактерії витримують температуру вище 850С, при 400С здатні розмножуватися.
На підприємствах харчової промисловості звязаних з виробництвом і переробкою сахарози, вони є небезпечними шкідниками, здатними розвиватися у застійних зонах, утворюючи вязку гелеподібну масу, відому під назвою "клейок", яка ускладнює транспортування рідких продуктів по комунікаціях і викликає прямі втрати сахарози на цукрових заводах, а також при переробці меляси на спиртзаводах.
Декстранове бродіння може бути причиною псування молочних консервів, куди слизеутворюючі бактерії попадають разом з сахарозою.
Геміцелюлози – це складна суміш полісахаридів, які не розчиняються у воді, але розчинні у лужних розчинах.
Геміцелюлози входять до складу різної рослинної сировини: деревини, злаків, трав, водоростей. Їх вміст залежить від виду сировини та може досягати 38-39% (кукурудзяні стрижні, плівки вівса і т.д.).
Геміцелюлози обовязкова складова частина клітинних стінок.
Продукти гідроліза геміцелюлоз: маноза, галактоза, арабіноза, ксилоза.
Геміцеллюлози по
Читайте також:
- II. Будова доменної печі (ДП) і її робота
- Анатомічна будова кісток вільної нижньої кінцівки
- Анатомо-фізіологічна перебудова організму підлітка
- Анатомо-фізіологічна перебудова організму підлітка та її вплив на його психологічні особливості й поведінку.
- Антигенна будова HDV
- АСОЦІАЦІЯ. ПОБУДОВА АСОЦІАТИВНОГО КУЩА
- Атмосфера. ЇЇ хімічний склад та будова
- Атомно-молекулярна будова речовини.
- Базис і надбудова.
- Біоелектричні явища в тканинах: будова мембран клітини, транспорт речовин через мембрану, потенціал дії та його розповсюдження.
- Будова автономної нервової системи
- Будова активного центру ферментів
| <== попередня сторінка | | | наступна сторінка ==> |
| Основна | | | Тема 1. Поняття, суть і завдання кримінального процесу |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |