
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Статистичний і термодинамічний методи дослідження. Тепловий рух. Основні поняття
РОЗДІЛ 2. ОСНОВИ МОЛЕКУЛЯРНОЇ ФІЗИКИ І ТЕРМОДИНАМІКИ
Молекулярна фізика вивчає фізичні властивості і агрегатні стани тіл в залежності від їх молекулярної будови, сил взаємодії між складовими частинками тіл і характеру теплового руху цих частинок. Термодинаміка або наука про теплоту теж вивчає властивості тіл і зміни станів речовини. Названі розділи фізики відрізняються лише використовуваними методами дослідження, що взаємно доповнюють один одного.
Молекулярно-кінетичний або статистичний метод опису стану системи базується на положенні про молекулярну будову речовини та безперервний тепловий рух молекул, використовує закономірності великого числа частинок, з яких складається розглядувана система. При цьому рухом окремих молекул не цікавляться, а оперують параметрами стану системи, що спостерігаються на досліді: тиском (р), температурою (Т) і об’ємом (V). Зв’язок між цими параметрами для заданої маси речовини називається рівнянням стану системи. Загальна форма запису рівняння стану f (р,V,T) =0,де f – деяка функція.
Термодинамічний метод полягає у вивченні властивостей системи взаємодіючих тіл шляхом аналізу кількісних співвідношень та умов перетворень енергії. При цьому не використовуються ніякі уявлення про внутрішню будову і характер руху мікрочастинок. Вивчаються макроскопічні характеристики системи на основі кількох експериментально встановлених законів – начал термодинаміки.
Термодинамічна система – це сукупність макрооб’єктів (тіл і полів), що обмінюються енергією у формі роботи і тепла як між собою, так із зовнішнім середовищем.
Рівноважним станом системи називають такий стан, при якому всі параметри стану мають певні значення, постійні при незмінних зовнішніх умовах. Перехід системи з одного стану в інший називається процесом. Якщо такий перехід дуже повільний (в ідеальному випадку – безмежно повільний), то процес буде послідовністю рівноважних станів.
Ідеальним газом називається система невзаємодіючих матеріальних точок, що при зіткненні ведуть себе як абсолютно пружні кульки. Практично – це газ, у котрого розміри молекул значно менші від середньої міжмолекулярної відстані.
Моль – це така кількість речовини, число частинок в якій рівне числу атомів у 12 г ізотопу вуглецю 12С.
Число молекул у молі будь-якої речовини однакове і називається сталою Авогадро; 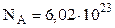
 (з досліду).
(з досліду).
Кількість речовин (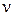 ) можна виразити через її масу (m)
) можна виразити через її масу (m) 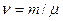 , або через число молекул (N)
, або через число молекул (N)  , де
, де  – молярна маса. Молярна маса пов’язана з масою однієї молекули
– молярна маса. Молярна маса пов’язана з масою однієї молекули 
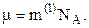
§ 2.2. Рівняння стану ідеального газу
Рівняння стану ідеального газу має три еквівалентні форми запису (при цьому маса газу m=const!). Перша з них – узагальнення експериментально встановлених законів Бойля-Маріота, Гей-Люсака і Шарля, відоме як рівняння Клапейрона:
 (2.1)
(2.1)
(стала різна для різних газів і для різної кількості одного газу).
Окремі випадки:
а) Т=сonst, рівняння ізотерми pV=const;
б) p=const, рівняння ізобари V/T=const;
в) V=const, рівняння ізохори p/T=const.
Закон Авогадро: при однакових тисках і однакових температурах в рівних об’ємах різних газів міститься однакове число молекул. Інше формулювання цього закону: при однакових тисках і однакових температурах молі різних газів займають однакові об’єми. Зокрема, при нормальних умовах ( ) молярний об’єм ідеального газу
) молярний об’єм ідеального газу 
Виходячи з закону Авогадро маємо, що в рівнянні (2.1) для 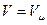 величина сталої однакова для всіх газів. Позначивши її через R, одержимо
величина сталої однакова для всіх газів. Позначивши її через R, одержимо
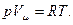 (2.2)
(2.2)
Вираз (2.2) – рівняння стану для одного моля ідеального газу. R – універсальна газова стала. Числове значення для R знайдемо з рівняння (2.2) при нормальних умовах:

Домножимо праву і ліву частину рівняння (2.2) на кількість речовини (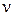 ). Врахувавши, що
). Врахувавши, що 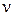 молів займають об’єм у
молів займають об’єм у 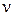 разів більший від об’єму одного моля
разів більший від об’єму одного моля  одержимо
одержимо
 (2.3)
(2.3)
Співвідношення (2.3) – рівняння Менделєєва-Клапейрона. Це – друга форма запису рівняння стану ідеального газу.
Визначаючи з рівняння  масу “m” газу і розділюючи одержаний вираз на об’єм, одержимо формулу для розрахунку густини газу
масу “m” газу і розділюючи одержаний вираз на об’єм, одержимо формулу для розрахунку густини газу
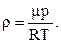 (2.4)
(2.4)
Введемо тепер сталу Больцмана
 . (2.5)
. (2.5)
Підставляючи у праву частину (2.5) значення R та  , одержимо
, одержимо 
Виразимо тепер на основі рівності (2.5) універсальну газову сталу через k та NA і врахуємо, що 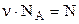 (число молекул). Маємо з рівняння (2.3):
(число молекул). Маємо з рівняння (2.3):
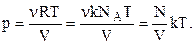
За означенням число молекул в одиниці об’єму – це концентрація молекул:
 (2.6)
(2.6)
 . З урахуванням цього попередня рівність набуде вигляду
. З урахуванням цього попередня рівність набуде вигляду
 (2.7)
(2.7)
Вираз (2.7) – третя форма запису рівняння стану ідеального газу (через концентрацію).
Відмітимо ще два факти, пов’язані з концентрацією: а) концентрація молекул ідеального газу за нормальних умов 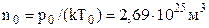 називається сталою Лошмідта; б) густину газу можна розраховувати як добуток концентрації і маси однієї молекули
називається сталою Лошмідта; б) густину газу можна розраховувати як добуток концентрації і маси однієї молекули  (це випливає з фізичного змісту величин
(це випливає з фізичного змісту величин 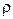 та n).
та n).
У випадку суміші  газів число всіх молекул
газів число всіх молекул 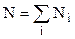 ,
, 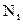 – число молекул і-го сорту. Тоді рівняння (2.7) з урахуванням (2.6) дає
– число молекул і-го сорту. Тоді рівняння (2.7) з урахуванням (2.6) дає
 ,
,
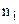 – концентрація молекул і-го сорту.
– концентрація молекул і-го сорту.  – парціальний тиск і-ї компоненти суміші, тобто тиск, який створював би даний (і-й) газ, якщо б він сам займав об’єм, рівний об’єму суміші при цій же температурі. Остаточно маємо
– парціальний тиск і-ї компоненти суміші, тобто тиск, який створював би даний (і-й) газ, якщо б він сам займав об’єм, рівний об’єму суміші при цій же температурі. Остаточно маємо
 (2.8)
(2.8)
тобто тиск суміші газів рівний сумі парціальних тисків (закон Дальтона).
Щоб розрахувати молярну масу суміші газів, розпишемо ліву і праву частину співвідношення (2.8), виходячи з рівняння Менделєєва-Клапейрона:
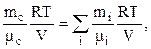
 – відповідно маса та молярна маса і-ї компоненти суміші;
– відповідно маса та молярна маса і-ї компоненти суміші; 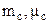 – маса та молярна маса суміші газів. З останнього рівняння маємо
– маса та молярна маса суміші газів. З останнього рівняння маємо
 або
або 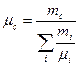 . (2.9)
. (2.9)
§ 2.3. Основне рівняння молекулярно-кінетичної теорії газів
Знайдемо рівняння, що пов’язує параметри стану ідеального газу тиск і об’єм з характеристикою руху його молекул – кінетичною енергією їх поступального руху.
Тиск розрахуємо за означенням як силу, що діє на одиницю площі стінки посудини перпендикулярно до неї за рахунок ударів молекул об стінку при їх хаотичному русі, а силу тиску – на основі 2-го закону Ньютона (через зміну імпульсу).
Нехай газ ідеальний однорідний, удари об стінку абсолютно пружні, число зіткнень молекул між собою зникаюче мале порівняно з числом зіткнень зі стінкою.
 Виділимо на стінці малу площадку
Виділимо на стінці малу площадку 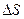 (див. рис.2.1). При кожному нормальному пружному ударі молекула масою
(див. рис.2.1). При кожному нормальному пружному ударі молекула масою 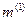 , що рухається зі швидкістю
, що рухається зі швидкістю 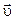 , змінює імпульс на
, змінює імпульс на 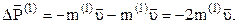
Для спрощення розрахунку приймемо, що модулі швидкостей молекул однакові, і замінимо мислено їх хаотичний рух рухом у трьох взаємно перпендикулярних напрямках, так що з усіх N молекул в об’ємі V посудини 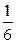 N частинок рухається в напрямку осі х, перпендикулярної до площадки. З цих 1/6 N молекул за деякий невеликий проміжок часу
N частинок рухається в напрямку осі х, перпендикулярної до площадки. З цих 1/6 N молекул за деякий невеликий проміжок часу  до площадки доберуться лише
до площадки доберуться лише 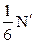 частинок, де
частинок, де  – число молекул, що знаходяться в циліндрі об’ємом
– число молекул, що знаходяться в циліндрі об’ємом 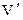 з основою
з основою 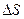 та висотою
та висотою 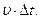 Їх є
Їх є 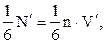 бо концентрація молекул n за рахунок хаосу однакова у всіх місцях посудини. Отже
бо концентрація молекул n за рахунок хаосу однакова у всіх місцях посудини. Отже 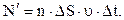 Ці
Ці  молекул при зіткненні з площадкою призведуть до зміни її імпульсу, причому
молекул при зіткненні з площадкою призведуть до зміни її імпульсу, причому

(модулі зміни імпульсу стінки і зміни імпульсу молекул рівні на основі закону збереження імпульсу).
Середня за час 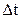 сила тиску
сила тиску  .
.
Тиск 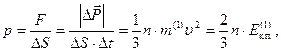
де  – кінетична енергія поступального руху однієї молекули газу.
– кінетична енергія поступального руху однієї молекули газу.
Якщо врахувати, що модулі швидкостей молекул різні, то кінцевий результат матиме вигляд
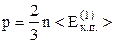 (2.10)
(2.10)
(символ 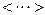 позначає середнє значення відповідної величини). Ця ж формула одержиться, якщо не замінювати хаотичний рух у всіх напрямках рухом у трьох взаємно перпендикулярних напрямках. Співвідношення (2.10) – основне рівняння молекулярно-кінетичної теорії (м.к.т.) газів.
позначає середнє значення відповідної величини). Ця ж формула одержиться, якщо не замінювати хаотичний рух у всіх напрямках рухом у трьох взаємно перпендикулярних напрямках. Співвідношення (2.10) – основне рівняння молекулярно-кінетичної теорії (м.к.т.) газів.
§ 2.4. Середня квадратична швидкість молекул. Молекулярно-кінетичне тлумачення температури
В основне рівняння м.к.т. газів входить середня кінетична енергія поступального руху однієї молекули газу
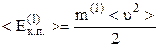 , (2.11)
, (2.11)
де середній квадрат швидкості молекули
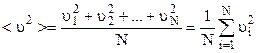 .
.
Введемо за означенням середню квадратичну швидкість молекули
 . (2.12)
. (2.12)
З урахуванням останнього вираз (2.11) запишемо так:
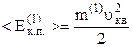 . (2.13)
. (2.13)
Порівняємо тепер співвідношення (2.10) і (2.7). Маємо

або 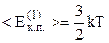 . (2.14)
. (2.14)
Звідси видно, що  прямопропорційна абсолютній температурі газу і залежить лише від неї. Значить температура є мірою середньої кінетичної енергії поступального руху молекул ідеального газу; саме формула (2.14) дала можливість такого молекулярно-кінетичного трактування абсолютної температури. Оскільки температура – міра середньої величини енергії, то про температуру однієї чи кількох молекул не говорять. При
прямопропорційна абсолютній температурі газу і залежить лише від неї. Значить температура є мірою середньої кінетичної енергії поступального руху молекул ідеального газу; саме формула (2.14) дала можливість такого молекулярно-кінетичного трактування абсолютної температури. Оскільки температура – міра середньої величини енергії, то про температуру однієї чи кількох молекул не говорять. При 
 , тобто при абсолютному нулю температури припиняється поступальний рух молекул, а, отже, зникає тиск газу, що спричиняється ударами молекул об стінки посудини. Однак досягти абсолютного нуля неможливо.
, тобто при абсолютному нулю температури припиняється поступальний рух молекул, а, отже, зникає тиск газу, що спричиняється ударами молекул об стінки посудини. Однак досягти абсолютного нуля неможливо.
Оскільки величина  не залежить від маси молекули, то стає зрозумілим, чому в суміші газів окремі компоненти створюють незалежно парціальні тиски
не залежить від маси молекули, то стає зрозумілим, чому в суміші газів окремі компоненти створюють незалежно парціальні тиски  (див. закон Дальтона).
(див. закон Дальтона).
Знайдемо тепер формулу для розрахунку величини середньої квадратичної швидкості хаотичного теплового руху молекул газу. Для цього прирівняємо праві частини співвідношень (2.13) і (2.14):
 , звідки
, звідки
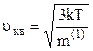 . (2.15)
. (2.15)
Оскільки 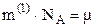 , а
, а  , то поділивши останнє рівняння на попереднє, маємо
, то поділивши останнє рівняння на попереднє, маємо 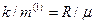 . Тоді
. Тоді
 . (2.16)
. (2.16)
Якщо вираз (2.15) дозволяє розрахувати 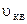 через масу молекули газу
через масу молекули газу  , то (2.16) – через молярну масу
, то (2.16) – через молярну масу  . Розрахунок на основі (2.16), наприклад, для азоту за нормальних умов дає
. Розрахунок на основі (2.16), наприклад, для азоту за нормальних умов дає  , для водню – 2000м/с.
, для водню – 2000м/с.
Виведемо ще одну форму запису основного рівняння м.к.т. газів. Домноживши рівняння (2.10) на об’єм V, маємо
 .
.
Але nV=N (див. означення (2.6)), а згідно з виразом (2.11) з урахуванням означення 
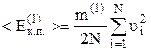 , тому
, тому
 .
.
У свою чергу 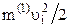 – це кінетична енергія поступального руху і-ї молекули газу, а
– це кінетична енергія поступального руху і-ї молекули газу, а  – кінетична енергія поступального руху всіх молекул газу
– кінетична енергія поступального руху всіх молекул газу  , тому остаточно
, тому остаточно
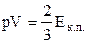 . (2.17)
. (2.17)
§ 2.5. Розподіл Максвела молекул за швидкостями та енергіями
Молекули газу рухаються хаотично, весь час змінюючи при зіткненнях величини і напрямки своїх швидкостей. У зв’язку з величезною кількістю молекул (див., напр., сталу Лошмідта) навіть у малому об’ємі неможливо встановити ні теоретично, ні дослідним шляхом, з якою швидкістю рухається кожна молекула в даний момент часу. Говорять, наприклад, про середню квадратичну швидкість, введену в попередньому параграфі, чи про середню арифметичну швидкість хаотичного теплового руху молекул
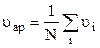
(позначення стандартні). При цьому виникає таке питання: чи є середня квадратична або середня арифметична швидкість переважною швидкістю руху? Чи, може, більша частина з усіх N молекул, що знаходяться в деякому об’ємі, характеризується якоюсь іншою переважною швидкістю руху? Таку задачу для ідеального газу розв’язав теоретично Максвел (1860 р.). Він знайшов з допомогою методів теорії ймовірностей такий розподіл молекул за швидкостями:
 . (2.18)
. (2.18)
Тут dN – число молекул газу, швидкості яких лежать в інтервалі від 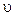 до
до 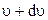 .
.
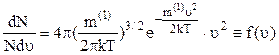 –
–
функція розподілу молекул за швидкостями. Вона показує відносну кількість молекул, швидкості яких при даній температурі перебувають в одиничному інтервалі біля значення швидкості 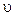 .
.
Розподіл Максвела можна записати наближено в інтегральній формі (замінивши значки диференціалів d значками скінчених приростів  ), але лише для вузького інтервалу
), але лише для вузького інтервалу 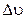 швидкостей, в котрому можна вважати функцію f постійною. Тоді
швидкостей, в котрому можна вважати функцію f постійною. Тоді
 при
при  ,
,
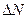 – число молекул, що рухаються з швидкостями, модулі яких в інтервалі від
– число молекул, що рухаються з швидкостями, модулі яких в інтервалі від 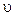 до
до 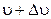 .
.
 Досліджуючи функцію
Досліджуючи функцію  на екстремум, одержують, що при деякому значенні
на екстремум, одержують, що при деякому значенні  (або
(або 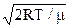 ) вона має максимум. Величину
) вона має максимум. Величину 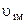 називають найімовірнішою швидкістю хаотичного теплового руху молекул газу. З використанням введеного позначення розподіл Максвела (2.18) записується простіше:
називають найімовірнішою швидкістю хаотичного теплового руху молекул газу. З використанням введеного позначення розподіл Максвела (2.18) записується простіше:
 .
.
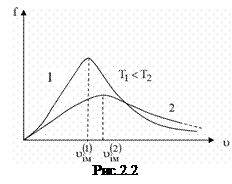
Функція розподілу 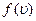 графічно подана на рис.2.2. З ростом температури положення максимуму зміщується вправо (адже
графічно подана на рис.2.2. З ростом температури положення максимуму зміщується вправо (адже  ); одночасно крива “осідає” так, що площа під нею залишається постійною (і рівною одиниці, як для всякої функції розподілу ймовірностей).
); одночасно крива “осідає” так, що площа під нею залишається постійною (і рівною одиниці, як для всякої функції розподілу ймовірностей).
Користуючись розподілом Максвела, можна розрахувати середню арифметичну швидкість молекул, введену вище:
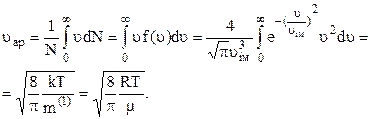
Аналогічно
 і далі на основі означення (2.12) одержуємо вираз (2.15) для розрахунку середньої квадратичної швидкості молекул.
і далі на основі означення (2.12) одержуємо вираз (2.15) для розрахунку середньої квадратичної швидкості молекул.
Оскільки 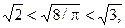 то маємо порівняння швидкостей
то маємо порівняння швидкостей  .
.
Ще одна форма запису розподілу (2.18), через відносну швидкість 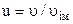 :
:
 ,
, 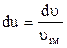 .
.
Іноді розподіл Максвела записують не через число молекул (N), а через концентрацію (n); оскільки dN/N=dn/n, то 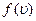 – та ж функція.
– та ж функція.
 Переходячи від швидкостей до кінетичних енергій поступального руху молекул (шляхом заміни змінної
Переходячи від швидкостей до кінетичних енергій поступального руху молекул (шляхом заміни змінної 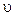 на змінну
на змінну 
 ,
,  , одержують розподіл молекул за їх кінетичними енергіями
, одержують розподіл молекул за їх кінетичними енергіями
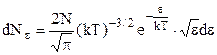 ,
,
 – число молекул, кінетична енергія поступального руху яких має значення в межах від
– число молекул, кінетична енергія поступального руху яких має значення в межах від 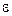 до
до 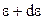 .
.
Розподіл Максвела надійно підтверджений дослідом. Вперше це було зроблено Штерном (1920 р.). По осі двох коаксіальних циліндрів (див. рис. 2.3) була натягнута платинова нитка, покрита сріблом. По нитці пропускався електричний струм, внаслідок чого атоми Ag випаровувалися і рухалися в різних напрямках зі швидкостями, що відповідали температурі нитки. У внутрішньому циліндрі було зроблено вузьку вертикальну щілину, через яку атоми могли досягати поверхні другого циліндра, де осідали. Всю установку обертали навколо осі з деякою кутовою швидкістю. Пучок атомів відхилявся при цьому (діяла сила Коріоліса в системі відліку, зв’язаній з циліндрами, різна для різних швидкостей атомів). Асиметричний розподіл атомів срібла на стінці зовнішнього циліндра нагадує розподіл Максвела.
§ 2.6. Барометрична формула. Розподіл Больцмана частинок у потенціальному полі
Атмосферний тиск на висоті h над Землею зумовлений вагою шарів повітря, що знаходяться на більших від h висотах. Позначимо тиск на висоті h через р. Тоді
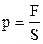 , (2.19)
, (2.19)
 F – вага циліндричного стовпа повітря, S – площа основи циліндра (див. рис.2.4). На висоті h+dh тиск буде p+dp, причому на основі виразу (2.19)
F – вага циліндричного стовпа повітря, S – площа основи циліндра (див. рис.2.4). На висоті h+dh тиск буде p+dp, причому на основі виразу (2.19)
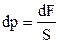 .
.
Із збільшенням висоти h вага верхнього стовпа повітря зменшується  , а вага нижнього стовпчика (заштрихованого на рис. 2.4) зростає на стільки ж
, а вага нижнього стовпчика (заштрихованого на рис. 2.4) зростає на стільки ж 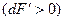 . Тому
. Тому 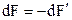 .
.
Далі
 ,
,
де dm – маса молекул повітря в заштрихованому елементарному об’ємі dV, g – прискорення вільнопадаючих тіл, 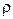 – густина повітря на висоті h. Видно, що при виведенні співвідношення
– густина повітря на висоті h. Видно, що при виведенні співвідношення
 (2.20)
(2.20)
зміною 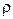 і g в об’ємі dV знехтувано.
і g в об’ємі dV знехтувано.
Повітря мало відрізняється від ідеального газу при звичайних умовах, тому
 (2.21)
(2.21)
(див. формулу (2.4) з відповідними позначеннями). Молярна маса повітря 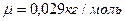 (визначена на основі співвідношення (2.9) з урахуванням процентного вмісту азоту, кисню та інших газів).
(визначена на основі співвідношення (2.9) з урахуванням процентного вмісту азоту, кисню та інших газів).
Підставимо вираз (2.21) у рівняння (2.20) і одержане співвідношення розділимо на р. В результаті маємо
 .
.
Будемо вважати нижче величини Т і g незалежними від h (таке допущення годиться для невеликих висот). Тоді останнє рівняння є диференціальним рівнянням з розділеними змінними. Інтегруючи його, маємо
 ,
,
с – деяка постійна величина. Потенціюємо тепер одержане співвідношення і одержимо

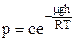 .
.
Нехай на поверхні Землі (h=0) p=p0. Тоді с=р0 і остаточно маємо
 . (2.22)
. (2.22)
Формула (2.22) називається барометричною. З неї випливає, що тиск газу зменшується з висотою за експоненціальним законом, причому тим швидше, чим важчий газ і чим нижча температура. Залежність атмосферного тиску від висоти графічно відображена на рис.2.5. Оцінка на основі виразу (2.22) дає, що при підйомі на 6 км тиск падає приблизно у два рази.
Виразимо тепер у формулі (2.22) тиск через концентрацію молекул на основі рівняння стану (2.7):
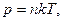
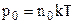
(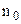 тут концентрація молекул на висоті
тут концентрація молекул на висоті  , а не стала Лошмідта!). Перейдемо також від молярної маси до маси однієї молекули за відомим зв’язком
, а не стала Лошмідта!). Перейдемо також від молярної маси до маси однієї молекули за відомим зв’язком 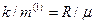 . Тоді матимемо
. Тоді матимемо
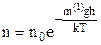 . (2.23)
. (2.23)
Останній вираз дає розподіл концентрації молекул в залежності від висоти над Землею, а саме: із збільшенням висоти концентрація зменшується. Якби абсолютна температура була рівна нулю, то концентрація молекул в атмосфері теж була б рівною нулю, всі вони упали б на Землю під дією сили тяжіння. Саме хаотичний тепловий рух молекул утримує атмосферу.
На висоті h кожна молекула володіє у полі тяжіння потенціальною енергією  , тому співвідношення (2.23) можна записати ще так:
, тому співвідношення (2.23) можна записати ще так:
 . (2.24)
. (2.24)
Молекули розміщуються густіше там, де менша їх потенціальна енергія. Больцман довів, що розподіл частинок за їх потенціальними енергіями (2.4) є універсальним, тобто годиться для будь-якого потенціального поля сил, а не лише для поля тяжіння. Тому вираз (2.24) називають розподілом Больцмана.
§ 2.7. Внутрішня енергія системи. Теплота і робота
Під внутрішньою енергією системи розуміють сумарну енергію частинок, з яких складається система. Сюди входить кінетична і потенціальна енергія молекул, енергія коливальних рухів атомів у молекулах, енергія електронних оболонок в атомах та іонах і внутрішньоядерна енергія. До внутрішньої не відноситься енергія системи як цілого, яку вона може мати в результаті механічного руху або взаємодії з іншими системами.
Внутрішня енергія є функцією стану системи, тобто змінюється із зміною стану системи і однозначно визначається тими самими параметрами, що й стан системи. Внутрішня енергія не залежить від способу, яким система переводиться з одного стану в інший. Це випливає із закону збереження і перетворення енергії, бо інакше, якби внутрішня енергія залежала від способу переходу системи з одного стану в інший, це означало б, що можна дістати енергію з нічого.
У термодинаміці практичне значення має не сама енергія, а її зміна з переходом системи зі стану в стан. У межах термодинамічних процесів внутрішня енергія змінюється тільки за рахунок зміни енергії теплового руху (тобто кінетичної енергії) частинок речовини та їх потенціальної енергії взаємодії. Енергія електронних оболонок атомів та іонів і внутрішньоядерна енергія при цьому залишаються незмінними і не становлять будь-якого інтересу. Тому вужче під внутрішньою енергією в термодинаміці розуміють лише сумарну енергію теплового руху частинок речовини та їх потенціальну енергію взаємодії.
Внутрішню енергію системи можна змінювати двома способами: виконанням механічної роботи і шляхом теплообміну. Наприклад, тиск газу в циліндрі під поршнем і, відповідно, енергію газу можна збільшити або переміщенням поршня і виконанням макроскопічної роботи над газом, або нагріванням газу при нерухомому поршні, тобто завдяки теплообміну газу з нагрівником через дно чи стінку циліндра. При теплообміні зміна внутрішньої енергії зумовлена тим, що окремі молекули гарячого тіла виконують роботу (мікроскопічну) над окремими молекулами холодного тіла. Теплообмін може відбуватися і через дотик тіл, і на відстані, за допомогою електромагнітного випромінювання (наприклад, між Сонцем і Землею). В загальному випадку теплообмін – це сукупність мікроскопічних процесів, що призводять до передачі енергії від тіла до тіла. Величина енергії хаотичного теплового руху молекул, що передається від одного тіла до другого шляхом теплообміну, називається кількістю теплоти. Таким чином, кількість теплоти є мірою процесу теплообміну, мірою зміни енергії невпорядкованого руху. Механічна робота (фізична величина) є мірою зміни і енергії впорядкованого руху (механічної енергії), і енергії невпорядкованого руху (внутрішньої енергії) тіл. Як робота, так і кількість теплоти не є функцією стану системи і має зміст лише у процесі перетворення (зміни) енергії.
Часто плутають поняття кількості теплоти з поняттям теплової енергії. Останнє – це сумарна енергія теплового руху частинок у тілі (частина внутрішньої енергії тіла), вона є функцією температури. Наприклад, вода і її пара при температурі кипіння мають однакову теплову енергію, хоча щоб перевести рідину в пару, треба надати їй деякої кількості теплоти. Ця кількість теплоти є мірою збільшення внутрішньої енергії пари, а не теплової енергії системи рідина-пара.
Кількість теплоти і робота, як величини, що визначають зміну внутрішньої енергії системи, у реальних процесах можуть бути взаємно зв’язаними і визначати одна одну.
§ 2.8. Робота розширення (стискання) газу
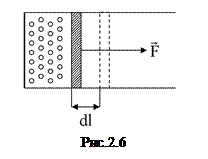 Розрахуємо роботу, що виконується газом при зміні його об’єму. Нехай газ поміщений в циліндричну посудину під тісно підігнаним поршнем, що може легко рухатися (рис. 2.6). З боку газу на поршень діє сила тиску F=pS, де р – тиск, S – площа основи поршня. Якщо газ, розширюючись, перемістить поршень на відстань
Розрахуємо роботу, що виконується газом при зміні його об’єму. Нехай газ поміщений в циліндричну посудину під тісно підігнаним поршнем, що може легко рухатися (рис. 2.6). З боку газу на поршень діє сила тиску F=pS, де р – тиск, S – площа основи поршня. Якщо газ, розширюючись, перемістить поршень на відстань  , то він виконає елементарну роботу
, то він виконає елементарну роботу  або
або 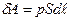 . Але
. Але 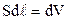 – елементарний приріст об’єму газу, тому остаточно
– елементарний приріст об’єму газу, тому остаточно
 . (2.25)
. (2.25)
Роботу скінченого приросту об’єму газу від 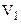 до
до 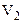 знаходимо як суму елементарних робіт
знаходимо як суму елементарних робіт
 . (2.26)
. (2.26)
 У випадку стискання газу напрямки сили
У випадку стискання газу напрямки сили  та переміщення поршня протилежні і
та переміщення поршня протилежні і  ,
,  . Приріст об’єму тепер теж від’ємний. Таким чином, вирази (2.25) та (2.26) годяться і у випадку стискання газу.
. Приріст об’єму тепер теж від’ємний. Таким чином, вирази (2.25) та (2.26) годяться і у випадку стискання газу.
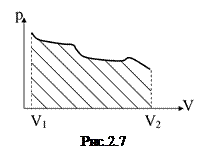
Зобразимо графічно залежність тиску газу від об’єму у процесі зміни останнього (діаграма p-V, рис.2.7). Виходячи з геометричного змісту інтегралу маємо, що робота газу, розрахована за формулою (2.26), чисельно рівна площі фігури, заштрихованої на рис. 2.7.
Застосуємо тепер вираз (2.26) до ізопроцесів. У випадку ізохорного процесу А=0, бо dV=0. При ізобарному процесі dp=0 і тиск можна винести з-під знаку інтегралу. Тоді маємо
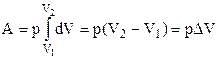 .
.
Якщо використати рівняння Менделєєва-Клапейрона 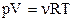 то маємо
то маємо  . Тоді робота ізобаричного розширення 1-го моля ідеального газу матиме вигляд
. Тоді робота ізобаричного розширення 1-го моля ідеального газу матиме вигляд  . Звідси
. Звідси  .
.
На основі останньої формули маємо фізичний зміст універсальної газової сталої: універсальна газова стала рівна роботі ізобаричного розширення одного моля ідеального газу при нагріванні його на один кельвін.
У випадку ізотермічного процесу dT=0. Тиск у формулу (2.26) підставимо з рівняння Менделєєва-Клапейрона 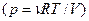 і, винісши сталі величини, виконаємо інтегрування:
і, винісши сталі величини, виконаємо інтегрування:
 .
.
Остаточно  . (2.27)
. (2.27)
Вираз (2.27) можна записати через відношення тисків, якщо скористатися законом Бойля-Маріота  :
:
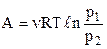 .
.
§ 2.9. Перше начало термодинаміки та його застосування до ізопроцесів
В термодинаміці розглядають тільки такі системи для яких механічна енергія системи як цілого не змінюється. За рахунок виконаної над системою роботи 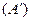 та переданої їй кількості теплоти
та переданої їй кількості теплоти 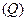 змінюється лише внутрішня енергія термодинамічної системи
змінюється лише внутрішня енергія термодинамічної системи 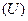 :
:
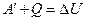 . (2.28)
. (2.28)
Тут  – приріст внутрішньої енергії
– приріст внутрішньої енергії  та
та  – початкове та кінцеве значення внутрішньої енергії). Співвідношення (2.28) відображає закон збереження і перетворення енергії стосовно теплових процесів.
– початкове та кінцеве значення внутрішньої енергії). Співвідношення (2.28) відображає закон збереження і перетворення енергії стосовно теплових процесів.
На відміну від механіки, де частіше приходилося обчислювати роботу зовнішніх сил, в термодинаміці, в основному, мають справу з роботою системи проти зовнішніх сил (А). Саме у зв’язку з цим ці величини тут перепозначені. Перейдемо тепер у рівнянні (2.28) від  до
до 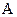 (
(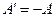 на основі третього закону Ньютона) і розв’яжемо одержане рівняння відносно Q:
на основі третього закону Ньютона) і розв’яжемо одержане рівняння відносно Q:
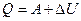 (2.29)
(2.29)
або в диференціальній формі
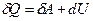 . (2.30)
. (2.30)
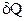 – елементарна кількість теплоти, так само як
– елементарна кількість теплоти, так само як 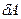 – елементарна робота;
– елементарна робота;  – елементарний приріст внутрішньої енергії.
– елементарний приріст внутрішньої енергії.
Співвідношення (2.29) (чи (2.30)) є математичним виразом першого начала (закону, принципу) термодинаміки. Формулювання цього принципу: кількість теплоти, наданої системі ззовні, витрачається на роботу системи проти зовнішніх сил і на збільшення внутрішньої енергії системи.
Не треба думати, що завжди за рахунок одержаного тепла внутрішня енергія системи збільшується. Може бути, що  ; при цьому на основі (2.29)
; при цьому на основі (2.29) 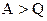 , тобто система виконує роботу як за рахунок одержаного тепла, так і за рахунок запасу внутрішньої енергії. Як і робота А, так і кількість теплоти Q є величина алгебраїчна: Q<0 означає, що система віддає тепло зовнішньому середовищу (холодильнику), а Q>0 означає, що система одержує тепло від нагрівника. Як і у випадку роботи, для кількості теплоти не можна писати
, тобто система виконує роботу як за рахунок одержаного тепла, так і за рахунок запасу внутрішньої енергії. Як і робота А, так і кількість теплоти Q є величина алгебраїчна: Q<0 означає, що система віддає тепло зовнішньому середовищу (холодильнику), а Q>0 означає, що система одержує тепло від нагрівника. Як і у випадку роботи, для кількості теплоти не можна писати 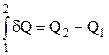 , бо останнє означало б, що значок варіації
, бо останнє означало б, що значок варіації  еквівалентний значку диференціала d, тобто що Q є функцією стану системи. Правильним є запис
еквівалентний значку диференціала d, тобто що Q є функцією стану системи. Правильним є запис  (сума елементарних кількостей теплоти рівна повній кількості теплоти). Тепер є очевидним, що інтегральна форма запису 1-го принципу термодинаміки (2.29) одержується з диференціальної (2.30), якщо останню проінтегрувати для деякого процесу, початок якого формально позначити “1”, а кінець – “2”:
(сума елементарних кількостей теплоти рівна повній кількості теплоти). Тепер є очевидним, що інтегральна форма запису 1-го принципу термодинаміки (2.29) одержується з диференціальної (2.30), якщо останню проінтегрувати для деякого процесу, початок якого формально позначити “1”, а кінець – “2”:
 .
.
Якісне формулювання 1-го принципу термодинаміки: неможливо побудувати періодично діючий двигун, який виконував би роботу більшу, ніж кількість переданої йому ззовні енергії (вічний двигун І-го роду неможливий).
Тепловий двигун, про який іде мова в якісному формулюванні принципу, це пристрій, що перетворює внутрішню енергію в механічну (“теплоту в роботу”). Основні частини такої установки – робоче тіло (газ, пара), нагрівник і холодильник. Періодично діючий двигун такий, що внаслідок процесу робоче тіло повертається за період до вихідного (початкового) стану; тоді 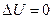 і
і  на основі (2.29).
на основі (2.29).
Застосуємо тепер 1-й принцип термодинаміки до ізопроцесів в ідеальному газі. Оскільки для ізохорного процесу  , то з рівняння (2.29) маємо, що
, то з рівняння (2.29) маємо, що  . Значить, при ізохорному процесі кількість теплоти, одержана газом ззовні, йде на збільшення внутрішньої енергії газу. При цьому температура газу підвищується (в наступному параграфі буде показано, що внутрішня енергія ідеального газу прямопропорційна абсолютній температурі).
. Значить, при ізохорному процесі кількість теплоти, одержана газом ззовні, йде на збільшення внутрішньої енергії газу. При цьому температура газу підвищується (в наступному параграфі буде показано, що внутрішня енергія ідеального газу прямопропорційна абсолютній температурі).
У випадку ізобаричного розширення ідеального газу  (див. попередній параграф); оскільки
(див. попередній параграф); оскільки  теж додатнє, бо
теж додатнє, бо  , то на основі (2.29)
, то на основі (2.29)  . Температура газу зростає. 1-й принцип термодинаміки для ізобаричного процесу формулюється як у загальному випадку.
. Температура газу зростає. 1-й принцип термодинаміки для ізобаричного процесу формулюється як у загальному випадку.
Для ізотермічного процесу робота газу розраховується за формулою (2.27). Оскільки  , то
, то 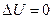 і вираз 1-го принципу (2.29) зводиться до наступного :
і вираз 1-го принципу (2.29) зводиться до наступного : 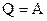 . Це означає, що при ізотермічному процесі кількість теплоти, одержана газом ззовні, йде на роботу газу проти зовнішніх сил.
. Це означає, що при ізотермічному процесі кількість теплоти, одержана газом ззовні, йде на роботу газу проти зовнішніх сил.
§ 2.10. Середня кінетична енергія молекул. Внутрішня енергія ідеального газу
Найменше число незалежних величин, які визначають положення системи у просторі, називається числом ступенів вільності системи. Наприклад, матеріальна точка має три ступені вільності, бо досить трьох координат x, y, z, щоб задати її положення. Система з N незалежних (або нежорстко зв’язаних) матеріальних точок має 3N ступенів вільності. Система з двох жорстко зв’язаних точок має п’ять ступенів вільності. Всякий жорсткий зв’язок, що закріплює відстань між двома точками, зменшує число ступенів вільності на одиницю. Тому система з трьох і більше жорстко зв’язаних матеріальних точок з нелінійним розміщенням має шість ступенів вільності. Три з них відповідають поступальному руху центра мас і ще три – обертальному руху системи навколо трьох взаємно перпендикулярних осей.
Молекули в першому наближенні можна розглядати як систему з жорстко зв’язаних матеріальних точок-атомів. При цьому число ступенів вільності для одноатомних молекул і=3, для двохатомних – і=5, для трьох і більше атомних – і=6.
У класичній статистичній фізиці Больцманом доведена теорема, що називається законом рівномірного розподілу кінетичної енергії молекул за ступенями вільності. Формулювання цього закону: на кожний ступінь вільності молекули в середньому припадає однакова кінетична енергія, рівна 1/2 kТ. Це означає, що молекула, яка характеризується числом ступенів вільності “і”, має середню кінетичну енергію
 . (2.31)
. (2.31)
Наприклад, для одноатомної молекули ця величина рівна 3/2 kT, що співпадає з середньою кінетичною енергією поступального руху (див. формулу (2.14)).
Займемося тепер розрахунком внутрішньої енергії ідеального газу. Молекули ідеального газу не взаємодіють між собою, тому для такої системи внутрішня енергія співпадає з сумарною кінетичною енергією молекул. Внутрішня енергія одного моля ідеального газу  . Якщо врахувати тепер вираз (2.31) та означення сталої Больцмана (2.5), то одержуємо
. Якщо врахувати тепер вираз (2.31) та означення сталої Больцмана (2.5), то одержуємо 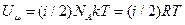 . Внутрішня енергія довільної кількості ідеального газу
. Внутрішня енергія довільної кількості ідеального газу  . Остаточно
. Остаточно
 . (2.32)
. (2.32)
§ 2.11. Теплоємність газів. Недоліки класичної теорії теплоємностей
Теплоємність тіла – це фізична величина, що чисельно рівна кількості теплоти, яку необхідно надати тілу, щоб підвищити його температуру на один кельвін.
Питома теплоємність – це теплоємність одиниці маси речовини, тобто вона рівна кількості теплоти, яку необхідно надати одиниці маси речовини, щоб підвищити її температуру на один кельвін:
 , (2.33)
, (2.33)
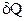 – елементарна кількість теплоти, що надається речовині, m – маса речовини, dT – елементарний приріст температури.
– елементарна кількість теплоти, що надається речовині, m – маса речовини, dT – елементарний приріст температури. 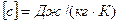 .
.
Молярна теплоємність – теплоємність одного моля речовини, тобто кількість теплоти необхідна для нагрівання одного моля речовини на один кельвін:
 , (2.34)
, (2.34)
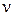 – кількість речовини.
– кількість речовини.  . Завваживши, що
. Завваживши, що 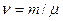 (
( – молярна маса), з порівняння формул (2.33) і (2.34) маємо зв’язок молярної теплоємності з питомою
– молярна маса), з порівняння формул (2.33) і (2.34) маємо зв’язок молярної теплоємності з питомою
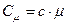 . (2.35)
. (2.35)
Теплоємність (питома чи молярна) є характеристикою речовини. Однак, виявляється, вона залежить ще й від процесу, тобто від умов нагрівання тіла. Покажемо це. Розрахуємо молярну теплоємність ідеального газу при сталому об’ємі 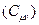 . З цією метою запишемо математичний вираз 1-го начала термодинаміки для ізохорного процесу
. З цією метою запишемо математичний вираз 1-го начала термодинаміки для ізохорного процесу 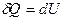 . Приріст внутрішньої енергії знайдемо, продиференціювавши співвідношення (2.32):
. Приріст внутрішньої енергії знайдемо, продиференціювавши співвідношення (2.32):
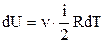 .
.
Тепер формула (2.34) дає
 .
.
Остаточно
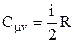 . (2.36)
. (2.36)
Зазначимо попутно, що тепер вираз (2.32) для внутрішньої енергії ідеального газу можна записати у формі
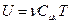 . (2.37)
. (2.37)
У випадку ізобаричного процесу вираз 1-го начала термодинаміки такий:
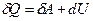 .
.
Елементарну роботу 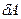 розрахуємо, виходячи з формули (2.25) і продиференціювавши рівняння Менделєєва-Клапейрона (2.3) за умови p=const:
розрахуємо, виходячи з формули (2.25) і продиференціювавши рівняння Менделєєва-Клапейрона (2.3) за умови p=const:
 .
.
Тепер на основі означення (2.34) маємо для молярної теплоємності ідеального газу при сталому тиску
 .
.
Взявши до уваги формулу (2.36), одержуємо
 . (2.38)
. (2.38)
Співвідношення (2.38) відоме як рівняння Майєра; воно дає зв’язок між молярними теплоємностями ідеального газу при сталому тиску та при сталому об’ємі.
З виразів (2.36) та (2.38) випливає, що: 1)  ; 2)
; 2)  та
та  не залежать від температури. Такі самі висновки робимо і відносно питомих теплоємностей (з огляду на зв’язок (2.35).
не залежать від температури. Такі самі висновки робимо і відносно питомих теплоємностей (з огляду на зв’язок (2.35).
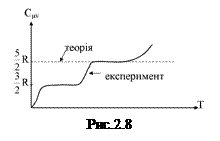 Експерименти показали, що результати розрахунків близькі до істинних лише для одно- і двоатомних газів і то лише в невеликих температурних інтервалах (в області кімнатних температур). На рис.2.8 подано графічно залежність
Експерименти показали, що результати розрахунків близькі до істинних лише для одно- і двоатомних газів і то лише в невеликих температурних інтервалах (в області кімнатних температур). На рис.2.8 подано графічно залежність  від Т для водню (число ступенів вільності і=5), одержану дослідним шляхом. Графік свідчить, що класична теорія теплоємностей справджується лише в окремих інтервалах середніх температур. В деякій області низьких температур молекули водню ведуть себе як системи, які мають лише ступені вільності поступального руху (рівень
від Т для водню (число ступенів вільності і=5), одержану дослідним шляхом. Графік свідчить, що класична теорія теплоємностей справджується лише в окремих інтервалах середніх температур. В деякій області низьких температур молекули водню ведуть себе як системи, які мають лише ступені вільності поступального руху (рівень 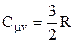 на рис.). З подальшим зниженням температури поступальний рух молекул стихає (“вимерзає”) і
на рис.). З подальшим зниженням температури поступальний рух молекул стихає (“вимерзає”) і 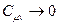 при
при  . При високих температурах проявляються ступені вільності, пов’язані з коливанням атомів всередині молекул (подана вище теорія цього не враховує). Правильне тлумачення результатів експерименту буде подано у квантовій теорії теплоємностей.
. При високих температурах проявляються ступені вільності, пов’язані з коливанням атомів всередині молекул (подана вище теорія цього не враховує). Правильне тлумачення результатів експерименту буде подано у квантовій теорії теплоємностей.
§ 2.12. Адіабатичний процес. Рівняння Пуасона
Адіабатичним (або адіабатним) називається процес, що протікає без теплообміну з навколишнім середовищем. Умова такого процесу: 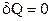 (або Q=0). Застосовуючи до адіабатичного процесу 1-й принцип термодинаміки (2.29), маємо
(або Q=0). Застосовуючи до адіабатичного процесу 1-й принцип термодинаміки (2.29), маємо
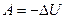 , (2.39)
, (2.39)
тобто при адіабатичному розширенні газ виконує роботу за рахунок запасу його внутрішньої енергії. При цьому ідеальний газ охолоджується. Дійсно, взявши до уваги вираз для внутрішньої енергії (2.37), маємо
 . (2.40)
. (2.40)
Звідси бачимо, що при розширенні газу (A>0) приріст температури  , в чому і треба було переконатися. Описане явище –– спосіб отримання низьких температур.
, в чому і треба було переконатися. Описане явище –– спосіб отримання низьких температур.
Вираз (2.40) дозволяє розрахувати роботу ідеального газу при адіабатичному процесі. Якщо використати рівняння Менделєєва-Клапейрона, то цю роботу можна виразити через параметри p та V.
Щоб здійснити адіабатичний процес, треба надійно теплоізолювати систему або здійснювати його дуже швидко, щоб теплообмін практично не встигав відбутися. Другий з цих варіантів зустрічається у природі. Наприклад, величезні маси атмосферного повітря, нагріваючись біля поверхні Землі, піднімаються вгору, потрапляють в області нижчих тисків і розширюються. Цей процес адіабатичний, бо через погану теплопровідність повітря теплообміном при цьому можна знехтувати. Виконуючи роботу розширення проти зовнішнього тиску, повітря охолоджується, а водяна пара перетворюється в насичену й конденсується (хмари).
Згущення і розрідження, що утворюються у звуковій хвилі в газах, – це також по суті процеси адіабатичного стиснення і розширення газу. Оскільки швидкість поширення звуку немала (340 м/с при кімнатних температурах), процеси тут відбуваються так швидко, що за цей короткий час теплообміном можна знехтувати.
Приступимо тепер до виведення рівняння адіабати. За основу беремо вираз 1-го принципу термодинаміки для цього процесу (в диференціальній формі (2.30)):
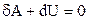 . (2.41)
. (2.41)
Розпишемо ліву і праву частину цього рівняння. Елементарну роботу 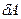 розрахуємо на основі формули (2.25), причому тиск підставимо, взявши його з рівняння Менделєєва-Клапейрона (2.3):
розрахуємо на основі формули (2.25), причому тиск підставимо, взявши його з рівняння Менделєєва-Клапейрона (2.3):
 .
.
Елементарний приріст внутрішньої енергії dU запишемо, продиференціювавши вираз (2.37):
 .
.
Тепер замість (2.41) маємо
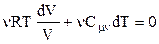 .
.
Поділимо далі останнє рівняння на добуток 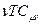 і одержимо
і одержимо
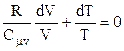 . (2.42)
. (2.42)
Коефіцієнт  запишемо, виразивши газову сталу через різницю
запишемо, виразивши газову сталу через різницю  з рівняння Майєра (2.38):
з рівняння Майєра (2.38):
 ,
,
де введено позначення  . (2.43)
. (2.43)
Тепер співвідношення (2.42) приймає вигляд
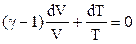 .
.
Оскільки  , то наше рівняння запишеться у формі
, то наше рівняння запишеться у формі
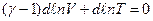
або 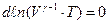 .
.
Звідси випливає, що
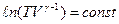
або 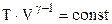 . (2.44)
. (2.44)
Співвідношення (2.44) є рівнянням адіабати або рівнянням Пуасона. Параметр  , введений вище, називається показником адіабати або коефіцієнтом Пуасона. Для повітря, наприклад,
, введений вище, називається показником адіабати або коефіцієнтом Пуасона. Для повітря, наприклад,  (у сухому повітрі 99 % двохатомних молекул!). В загальному випадку
(у сухому повітрі 99 % двохатомних молекул!). В загальному випадку 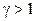 , оскільки
, оскільки  .
.
Визначаючи абсолютну температуру з рівняння Менделєєва-Клапейрона і підставляючи одержаний вираз у співвідношення (2.44), одержимо іншу форму запису рівняння Пуасона:
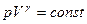 . (2.45)
. (2.45)
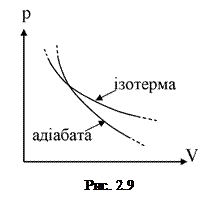 Згадаємо, що рівняння ізотерми
Згадаємо, що рівняння ізотерми 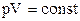 . Порівняння двох останніх виразів приводить до висновку, що адіабата графічно “крутіша” від ізотерми (див. рис.2.9).
. Порівняння двох останніх виразів приводить до висновку, що адіабата графічно “крутіша” від ізотерми (див. рис.2.9).
Якщо з рівняння Менделєєва-Клапейрона або з рівняння (2.45) визначити об’єм V і підставити одержаний вираз у (2.44), то матимемо третю форму запису рівняння Пуасона
 . (2.46)
. (2.46)
Зауваження: 1) рівняння Пуасона (2.44–46) правильні за умови, що кількість газу  (чи його маса) незмінні під час процесу; 2) величини “const” у всіх виписаних рівняннях різні.
(чи його маса) незмінні під час процесу; 2) величини “const” у всіх виписаних рівняннях різні.
§ 2.13. Оборотні та необоротні процеси. Цикли
Термодинамічний процес, що є неперервною послідовністю рівноважних станів, називається рівноважним (або квазістатичним). Якщо рівноважні стани на діаграмах (p-V чи p-T, чи V-T) зображають точками, то рівноважному процесу відповідає деяка крива, що проходить через ці точки.
Термодинамічний процес називається оборотним, якщо при виконанні його системою спочатку у прямому, а потім у зворотному напрямку, система і зовнішнє середовище повертаються у вихідний стан. Всякі інші процеси – необоротні. Можна показати, що критерієм оборотності процесу є його рівноважність.
 Оборотні процеси – ідеалізовані, до них реальні процеси лише можуть наближатися. Так, механічні процеси були б оборотними, якби не було тертя і не перетворювалася б механічна енергія у внутрішню. Всі реальні процеси, що супроводяться тертям, теплопровідністю або випромінюванням, є необоротними.
Оборотні процеси – ідеалізовані, до них реальні процеси лише можуть наближатися. Так, механічні процеси були б оборотними, якби не було тертя і не перетворювалася б механічна енергія у внутрішню. Всі реальні процеси, що супроводяться тертям, теплопровідністю або випромінюванням, є необоротними.
Коловим (круговим) процесом або циклом називають таку послідовність процесів, після завершення якої система повертається до початкового стану. На повторенні відповідних циклів грунтується неперервна дія кожної теплової машини (двигуна). Тому в колових процесах нас цікавитиме насамперед робота, яку виконує система в результаті виконання циклу. Речовину, над якою здійснюється коловий процес, називають робочим тілом.
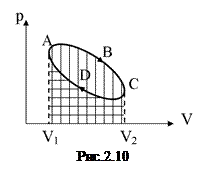
На діаграмі p-V цикл зображається у вигляді деякої замкнутої кривої (на рис. 2.10 крива АВСDА). Першій частині циклу (крива АВС) відповідає розширення робочого тіла, воно виконує позитивну роботу, що чисельно рівна площі фігури  , заштрихованій вертикальними лініями. У другій частині циклу, коли робоче тіло стискається, система виконує негативну роботу (робота виконується над системою!), що чисельно дорівнює площі фігури
, заштрихованій вертикальними лініями. У другій частині циклу, коли робоче тіло стискається, система виконує негативну роботу (робота виконується над системою!), що чисельно дорівнює площі фігури 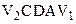 , заштрихованій горизонтальними лініями. Механічна робота А, виконана робочим тілом за цикл, чисельно дорівнює площі фігури АВСDА.
, заштрихованій горизонтальними лініями. Механічна робота А, виконана робочим тілом за цикл, чисельно дорівнює площі фігури АВСDА.
Очевидно, що для циклу зміна внутрішньої енергії робочого тіла рівна нулю. Тому на основі 1-го принципу термодинаміки одержується, що Q=A, тобто робота системи за цикл виконується за рахунок кількості теплоти, одержаної ззовні. Треба пам’ятати при цьому, що сам процес передавання теплоти від нагрівника до робочого тіла не супроводиться виконанням роботи (немає переміщення). Робота може виконуватися в результаті взаємодії робочого тіла з іншим тілом. Саме завдяки цій взаємодії відбувається стискання робочого тіла в другій частині циклу. Далі буде з’ясовано, що здійснити такий циклічний процес, при якому теплота, одержана від нагрівника, повністю перетворюється в механічну роботу, взагалі неможливо.
Розглянутий нами цикл АВСDА – прямий; робоче тіло виконує позитивну роботу (A>0 і Q>0). Так працює теплова машина. Цикл виконаний у зворотному напрямку (АDСВА на рис.),– зворотний. Легко переконатися, що у випадку зворотного циклу буде виконана робота (–А). У відповідності з 1-м началом термодинаміки тоді Q<0, тобто робоче тіло передає теплоту зовнішнім тілам. Маємо справу з холодильною машиною. У холодильній машині робоче тіло виконує зворотний цикл.
§ 2.14. Цикл Карно. Максимальний ККД теплової машини
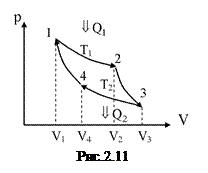 В якості прикладу колового процесу розглянемо цикл Карно, що складається з двох ізотермічних і двох адіабатичних процесів (див. рис.2.11). Звичайно мова йде про рівноважні процеси. Запропонований цикл – прямий оборотний.
В якості прикладу колового процесу розглянемо цикл Карно, що складається з двох ізотермічних і двох адіабатичних процесів (див. рис.2.11). Звичайно мова йде про рівноважні процеси. Запропонований цикл – прямий оборотний.
У процесі 1-2 робоче тіло в тепловому контакті з нагрівником, температура якого  ; воно одержує від нагрівника кількість теплоти
; воно одержує від нагрівника кількість теплоти  , і ізотермічно розширюється, виконуючи роботу
, і ізотермічно розширюється, виконуючи роботу 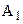 .
.
У процесі 2-3 відбувається адіабатичне розширення теплоізольованого тіла, воно виконує роботу  за рахунок запасу внутрішньої енергії; температура тіла падає від
за рахунок запасу внутрішньої енергії; температура тіла падає від  до
до 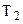 .
.
У процесі 3-4 робоче тіло ізотермічно стискається, перебуваючи в контакті з холодильником, температура якого 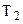 . Холодильнику віддається кількість теплоти
. Холодильнику віддається кількість теплоти  . Робота тіла при цьому
. Робота тіла при цьому  .
.
У процесі 4-1 робоче тіло знову теплоізольоване і адіабатично стискається, виконуючи роботу  . Температура зростає від
. Температура зростає від 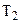 до
до 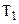 .
.
Введемо поняття коефіцієнта корисної дії (ККД) теплової машини як відношення виконаної за цикл роботи А до одержаного (за цикл) тепла  від нагрівника:
від нагрівника:
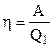 . (2.47)
. (2.47)
Оскільки зміна внутрішньої енергії тіла за цикл рівна нулю, то  , де
, де  – кількість теплоти, одержаної робочим тілом за цикл ззовні (від нагрівника та холодильника),
– кількість теплоти, одержаної робочим тілом за цикл ззовні (від нагрівника та холодильника),
 або
або 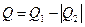 , бо
, бо 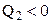 .
.
Розрахуємо ККД ідеального циклу Карно (робоче тіло – ідеальний газ, а нагрівник і холодильник характеризуються безмежно великими теплоємностями, щоб їх температури під час процесу не могли зміню
Читайте також:
- II. Основні закономірності ходу і розгалуження судин великого і малого кіл кровообігу
- II. Поняття соціального процесу.
- V. Поняття та ознаки (характеристики) злочинності
- А/. Поняття про судовий процес.
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Агрегативна стійкість, коагуляція суспензій. Методи отримання.
- Адаптовані й специфічні методи дослідження у журналістикознавстві
- Адвокатура в Україні: основні завдання і функції
- Адіабатичний тепловий вибух
- Адміністративний проступок: поняття, ознаки, види.
- Адміністративні (прямі) методи регулювання.
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
| <== попередня сторінка | | | наступна сторінка ==> |
| Гідродинаміка в’язкої рідини. Сила Стокcа | | | Електричний заряд. Електричне поле. Закон Кулона. Напруженість та індукція електричного поля. Принцип суперпозиції електричних полів |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |