
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Метод комплексоутворення
Лекція №11
Дисципліна: Фізична хімія та аналітичний контроль
Зміст
1. Загальна характеристика методу.
2. Меркуриметрія.
3. Комплексонометрія.
Контрольні питання
Література
Питання до самостійного вивчення
Викладач Ю.В. Старушенко
1. Загальна характеристика методу.
Реакції утворення комплексних і малодисоційованих сполук є основою методів визначення ряду іонів. Найбільше значення в титриметричному аналізі має комплексоутворення іонів металів з галогенід – та псевдогалогенід – іонами (SCN-, CN-), а також з групою поліамінокарбонових кислот, що об’єднуються загальною назвою «комплексони».
При титруванні іони металу і аніони звичайно сполучаються в легкорозчинну комплексну сполуку, яка залишається в розчині; лише в окремих випадках визначення супроводиться утворенням малорозчинної сполуки, що виділяється в осад.
Для встановлення точки еквівалентності застосовують найчастіше два способи:
1) у розчин вводять речовину, яка є індикатором на один з реагуючих іонів і утворює з ним забарвлену або малорозчинну сполуку. Індикатор підбирають так, що забарвлення або осад виникали (або зникали) тільки після того, коли практично всі визначувані іони будуть зв’язані відповідними іонами робочого розчину в комплексну сполуку;
2) еквівалентне співвідношення реагуючих речовин визначають за зміною рН розчину. У цьому випадку для визначення точки еквівалентності застосовують звичайні кислотно-основні індикатори.
Розглянемо докладніше основні типи визначень методом комплексоут- ворення.
2. Меркуриметрія.
В основі методу лежить утворення малодисоційованих галогенідів або псевдогалогенідів ртуті (II). Цим методом можна визначати хлориди, броміди, йодиди, роданіди і ціаніди, а також солі ртуті (II). Робочим розчином є розчин нітрату ртуті (II) Hg(NO3)2. При визначенні хлоридів і бромідів до розчину останніх добавляють робочий розчин Hg(NO3)2. Іони ртуті зв’язуються іонами галогенів у малодисоційовані HgС12 або HgВг2:
Нg2+ + 2С1- = НgС12.
Індикатором при цих визначеннях може бути розчин нітропрусиду натрію або дифенілкарбазиду чи дифенілкарбазону. Ці сполуки є реактивами на іони ртуті (II). Поки в розчині є іони хлору (чи брому), іони ртуті реагують з останніми, і взаємодія з індикатором не відбувається. Після добавляння надлишку робочого розчину іони ртуті вступають у реакцію з індикатором. При застосуванні розчину нітропрусиду натрію в точці еквівалентності утворюється білий осад:
Na2[Fe(CN)5NO] + Hg(NO3)2 = Hg[Fe(CN)5NO]2 + 2NaNO3
Найкращими індикаторами є дифенілкарбазид

І продукт окислення дифенілкарбазиду - дифенілкарбазон

Іони ртуті можуть заміщати водневі атоми імінних груп з утворенням забарвлених у фіолетово-рожевий колір сполук. Точку еквівалентності в цьому випадку встановлюють за фіолетово-рожевим забарвленням, що виникає при добавлянні невеликого надлишку іонів ртуті після зв’язування всіх іонів хлору.
Меркуриметричне визначення йодидів грунтується на такій реакції:
Hg2+ + 4I- = [HgI4]2-
У точці еквівалентності іони ртуті реагують з іонами І- , утворюючи осад йодиду ртуті (II) червоного кольору:
HgI + Hg2+ = 2HgI2
+ Hg2+ = 2HgI2
При визначенні роданідів, як індикатор, застосовують розчин солей заліза (III), які утворюють з роданід-іонами сполуку червоного кольору
Fe3+ + 3SCN- = Fe(SCN)3
Іони ртуті реагують з роданід-іонами за такою реакцією:
Hg2++ 2SCN- = Hg(SCN)2
Отже, після зв’язування роданіду червоне забарвлення Fe(SCN)3 зникає, що є ознакою кінця титрування. Аналогічно визначають добре дисоційовані солі ртуті (II), титруючи їх розчином роданіду калію в присутності іонів заліза (III). У точці еквівалентності виникає червоне забарвлення роданіду заліза.
Найбільше практичне значення має меркурометричне визначення хлоридів. Застосування нітрату ртуті (II) замість дорожчого препарату AgNO3, дає змогу заощадити значні кошти в лабораторіях, де проводяться масові визначення хлоридів.
3. Комплексонометрія.
Деякі поліамінокарбонові кислоти (комплексони) утворюють з катіонами металів стійкі комплексні сполуки Найбільш поширеним представником комплексонів є двонатрієва сіль етилендіамінтетраоцтової кислоти (скорочено ЕДТА), яка відома також під назвою трилону Б, або комплексону (III):
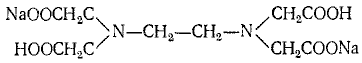
Схематичне позначення молекули трилону — Na2H2X.
'Грилон Б реагує в розчинах з катіонами міді, вісмуту, свинцю, кадмію, заліза, нікелю, кобальту, марганцю, цинку, торію, галію, індію,кальцію, стронцію, барію, магнію і деяких інших металів, утворюючи стійкі комплексні сполуки. Здатність трилону Б реагувати з такою великою кількістю катіонів зумовлюється присутністю в його молекулі одночасно кількох солетворнихкарбоксильних груп і комплексоутворюючих атомів азоту.
Трилон Б виявився дуже цінним реактивом для титриметричного аналізу. В усіх випадках реакція між трилоном Б і катіонами металів проходить за дуже простим рівнянням: 1 моль комплексону завжди реагує з 1 моль металу у випадку всіх дво- і тривалентних металів. Отже, при реакції не утворюється ніяких проміжних і побічних продуктів, присутність яких ускладнює визначення в інших методах титриметричногоа налізу. Специфічною особливістю трилону Б є також його здатність вступати в реакцію з катіонами ряду металів, для яких комплексоутворення з іншими лігандами не характерне. Так, трилон Б утворює стійкі сполуки з катіонами лужноземельних металів — барієм, стронцієм, кальцієм і магнієм. Сила споріднення трилону Б до цих металів характеризується, наприклад, тим, що осад сульфату барію легко розчиняється в розчині трилону Б (відомо, що до останнього часу сульфат барію вважали типовою нерозчинною сполукою, для якої не можна було знайти розчинника). Взаємодія трилону Б з лужноземельними металами є основою їх кількісного визначення, один з прикладів якого розглянуто нижче. Слід, нарешті, підкреслити, що реакція між трилоном Б і катіонами різних металів протікає в різних умовах кислотності: так, повне зв’язування лужноземельних металів відбувається лише в лужному середовищі, тоді як деякі тривалентні метали повністю реагують з трилоном Б навіть при досить низьких значеннях рН розчину. Це дає змогу визначати одні метали в присутності інших, регулюючи кислотність розчину.
Є два основних варіанти трилонометричного титрування, що грунтуються на різних способах встановлення точки еквівалентності.
У першому варіанті кінець титрування встановлюють за допомогою так званих металіндикаторів — речовин, що утворюють з катіонами металів забарвлені комплексні сполуки. Специфіку застосування металіндикаторів полягає в тому, що вони дають забарвлені сполуки з катіонами визначуваних металів і не реагують з іонами робочого розчину, тоді як у більшості інших методів титриметричного аналізу індикатор дає кольорову реакцію з речовиною робочого розчину, введеного в невеликому надлишку. Метал індикатори мають також власне забарвлення; тому в точці еквівалентності зникає забарвлення комплексної сполуки індикатора з катіоном металу і виникає забарвлення чистого індикатора. Одним з найбільш поширених металіндикаторів є кислотний
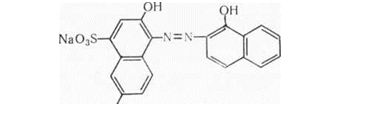 |
хром чорний спеціальний, або еріохром чорний Т.
Більшість трилонометричних визначень з цим індикатором проводиться в слабколужних розчинах (pH = 10 - 12), де переважна кількість індикатора перебуває у вигляді забарвлених у синій колір аніонів НІn2—. При добавлянні невеликої кількості індикатора до розчину солі металу весь індикатор переходить у забарвлену комплексну сполуку з катіоном металу, наприклад:
рН=6,3 pН=11,5
H2Ind–  HInd2–
HInd2–  Ind3–
Ind3–
винно- блакитний оранжевий
червоний
Отже, точка еквівалентності характеризується зміною винно-червоного кольору розчину на синій.
У другому варіанті трилонометричних визначень точку еквівалентності встановлюють, виходячи із зміни кислотно-основних властивостей системи під час титрування. До розчину солі металу добавляють надлишок робочого розчину трилону Б:
Ме2+ + Н2Х2- = МеХ2- + 2Н+.
Внаслідок реакції катіони металу витискують еквівалентну кількість іонів водню. Визначення закінчують титруванням виділеної кислоти робочим розчином їдкого лугу, використовуючи для встановлення точки еквівалентності звичайні кислотно-основні індикатори.
У практиці трилонометричних визначень останній метод має обмежене значення; найбільше поширений спосіб титрування — з металіндикаторами.
Читайте також:
- D) методу мозкового штурму.
- H) інноваційний менеджмент – це сукупність організаційно-економічних методів управління всіма стадіями інноваційного процесу.
- I Метод Шеннона-Фано
- I. Метод рiвних вiдрiзкiв.
- VII. Нахождение общего решения методом характеристик
- А. науковий факт, b. гіпотеза, с. метод
- Автоматизація водорозподілу на відкритих зрошувальних системах. Методи керування водорозподілом. Вимірювання рівня води. Вимірювання витрати.
- Агрегативна стійкість, коагуляція суспензій. Методи отримання.
- АгротехнІЧНИЙ метод
- Адаптовані й специфічні методи дослідження у журналістикознавстві
- Адміністративні (прямі) методи регулювання.
- Адміністративні методи - це сукупність прийомів, впливів, заснованих на використанні об'єктивних організаційних відносин між людьми та загальноорганізаційних принципів управління.
| <== попередня сторінка | | | наступна сторінка ==> |
| Взаємозв’язок фінансів з іншими економічними категоріями розподільчого характеру. | | | Категорії систем для управління персоналом |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |