
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Фізичні властивості.
План
Лекція №15-16
Контрольні запитання
1. Яке призначення протоколу HTTP (Hypertext Transfer Protocol)?
2. Яке призначення WWW (World Wide Web)?
3. Яке призначення сервісу URI (Uniform Resource Identifier)?
4. З яких частин складається сервіс URI?
5. Яке призначення HyperText Markup Language (HTML)?
6. Яке призначення стандарту Common Gateway Interface (CGI)?
7. По якій моделі побудований протокол HTTP?
8. Який принцип роботи найпростішої схеми взаємодії між клієнтом і сервером http?
9. Який принцип роботи схеми взаємодії клієнта і сервера через проміжні об'єкти мережі?
10. Який принцип роботи схеми використання кеша?
11. Яка структура запиту між клієнтом і сервером http?
Тема:Оксосполуки (альдегіди та кетони).
1. Будова. Номенклатура. Ізомерія.
2. Методи добування.
3. Фізичні властивості.
4. Хімічні властивості.
5. Значення та біологічні властивості альдегідів та кетонів.
1.Оксосполуки мають функціональну карбонільну оксогрупу: >C=O
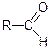
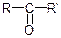
Альдегід Кетон
Класифікація. В залежності від того з яким радикалом зв'язана альдегідна або кетонна група.
Оксосполуки поділяють на:
а) аліфатичні (насичені та ненасичені);
б) ароматичні;
в) гетероциклічні.
Номенклатура. Для альдегідів найчастіше використовують тривіальну номенклатуру:
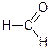 формальдегід (мурашиний альдегід)
формальдегід (мурашиний альдегід)
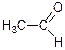 ацетальдегід
ацетальдегід
 пропіоновий
пропіоновий
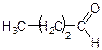 масляний
масляний
 валеріановий
валеріановий
 капроновий
капроновий
Інколи використовують раціональну номенклатуру (в основі лежить оцтовий альдегід):
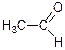 метилоцтовий
метилоцтовий
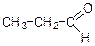 етилоцтовий
етилоцтовий
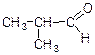 диметилоцтовий
диметилоцтовий
За номенклатурою ІЮПАК назви альдегідів утворюють з назв відповідних вуглеводнів додаючи до них суфікс -аль. Головний ланцюг в молекулі альдегіду вибирають так щоб в нього обов'язково входив атом вуглецю карбонільної групи. Нумерацію вуглецевого ланцюга починають з атома вуглецю карбонільної групи: метаналь, етаналь.
Ненасичені альдегіди:
 акриловий, акролеїн (пропеналь):
акриловий, акролеїн (пропеналь):
 кротоновий (2-бутиналь)
кротоновий (2-бутиналь)
Ароматичні:
 бензальдегід (бензойний альдегід).
бензальдегід (бензойний альдегід).
Альдегіди жирно-ароматичного ряду (аліматика та аліфатика):
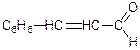 корічний альдегід
корічний альдегід
(фінілакріловий).
Кетони:
1) найчастіше використовують тривіальну назву:
 ацетон
ацетон
 диметилізопропіл
диметилізопропіл
2) за ІЮПАК назву кетонів також утворюють з відповідного вуглеводню додаючи до неї суфікс -он. У назві зазначають також номер атома вуглецю, сполученого з карбонільним атомом кисню (пропанон-петанон-2);
3) кетони називають часто за назвою радикалів, сполучених з карбонільною групою: диметилкетон, метилетилкетон (раціональна назва);
4) якщо молекула крім оксогрупи містить іншу функціональну групу, додають префікс -оксо (2-оксопропан, 3-метил-2-оксобутан).
Ненасичений зв'язок:
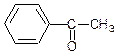 ацетофенон
ацетофенон
(метилфенілкетон)
 дифенілкетон
дифенілкетон
Ізомерія. Кетони та альдегіди ізомерні по відношенню один до одного.
Загальна формула: СпН2пО
Наприклад: 3-пропіоновий ізомерний ацетону
 ,
, 
Ізомерія альдегідів: пов'язана з розгалуження вуглецевого ланцюга радикала і в гомологічному ряду цих сполук починається з 4-го члена ряду, який існує у вигляді масляного та ізомасляного альдегідів;
ізомерія положення функції неможлива.
Для ненасичених альдегідів характерна геометрична ізомерія.
Ізомерія кетонів залежить як від будови алкільних груп радикалів, так і від положення карбонільної групи в молекулі кетону. Кетон, для якого починається ізомерія, має в своєму складі п'ять атомів вуглецю (пентанон-2, пентанон-3).
2. Методи добування:
а) окисленням спиртів: має інтерпретацію; з первинного спирту отримують альдегід, з вторинного – кетон; третинні спирти важко окислюються;

б) гідроліз гемінальних дігалогенпохідних;

в) оксосинтез (з ненасичених сполук);
г) піроліз суміші кальцієвих, магнієвих або торієвих солей, що приводить до утворення альдегідів або кетонів: якщо маємо суміш різноманітних кислот, утворюються різні кетони;
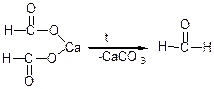
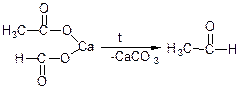
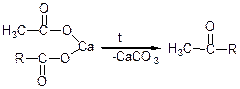
д) гідратація ацетиленових вуглеводнів (за реакцією Кучерова);
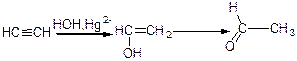
є) дегідрування спиртів:
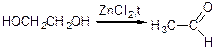
Ароматичні альдегіди:
е) з гліцерину (при прогорканні жирів):
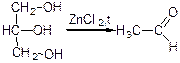
ж) з толуолу:
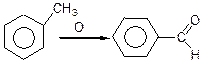
з) з діагалогенпохідних (лужний гідроліз)

Ненасичені альдегіди:
і) з галогенпохідного альдегіду:
и) реакція Фріделя-Кравтца (утворюються ароматичні кетони).

Найважливіший представник кетонів – ацетон. Методи добування наступні:
1) суха перегонка деревини;
2) ацетоново-бутанольне бродіння;
3) окислення пропанолу-2;
4) окислення кумолу (ізопропілбензолу).
Перший представник альдегідів – мурашиний альдегід – газ; інші нижчі альдегіди – рідини, легко розчинні у воді (ацетон); вищі альдегіди та кетони – тверді речовини.
В альдегідах та кетонах, на відміну від спиртів, немає рухомих атомів водню. Їх молекули не асоційовані, тому t0кип та t0пл значно нижче, ніж у відповідних спиртів.
Метаналь – газ Метанол – рідина
В той же час, t0кип оксосполук значно вищі за t0кип відповідних вуглеводнів. Це пов'язано з високою полярністю альдегідів та кетонів. Густина альдегідів та кетонів <1. Вважають, що карбонільна група – осмофор – носій запаху, мурашиний альдегід має різкий запах, його 40%-й водний розчин називають формаліном (консервант). Інші нижчі альдегіди мають задушливий запах, який при сильному розбавлянні стає приємним і нагадує запах овочів і фруктів. Кетони пахнуть досить приємно.
Фізико-хімічні властивості:
ІЧ-спектри мають інтенсивну смугу коливань карбонільної групи в області 1740-1720 см-1 (для альдегідів) і 1725-1705 см-1 (для кетонів).
Альдегіди мають валентне коливання С-Н-групи біля 2720 см-1.
В УФ-спектрах альдегіди та кетони поглинають в області 280 нм.
В спектрах ПМР сигнал протона альдегідної групи знаходиться в області 9-10 млн-1.
4. Хімічні властивості:
Електронна будова карбонільної групи С=О схожа з електронною будовою подвійного зв'язку, тобто в карбонільній групі С=О є один σ-зв'язок та один π-зв'язок. Карбон знаходиться в sp2-гібридному стані. На відміну від подвійного зв'язку, карбонільний зв'язок дуже поляризований в наслідок значно більшої електронегативності атома кисню.
Тому рухомі електрони π-зв'язку зміщуються в бік атома кисню. В результаті цього кисень має δ-, карбон δ+, зв'язок поляризований:

В зв'язку з тим, що зв'язок дуже поляризований, карбон δ+ відтягує на себе і сусіди мають δ+.
Внаслідок цього гідрогени при α-атомах карбону стають рухливими, Висока полярність зв'язку С=О сприяє високої реакційної здібності альдегідів та кетонів.
Найбільш характерні наступні реакції:
1) приєднання по карбонільній групі;
2) заміщення кисню карбонільної групи;
3) реакції в вуглеводневому радикалі;
4) реакції конденсації;
5) реакції полімеризації;
6) реакції окислення.
1.
а) приєднання гідрогену:
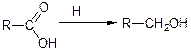
первинні спирти;
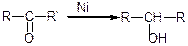
б) приєднання синільної кислоти:
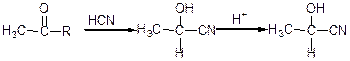
оксинітрил ацетальдегіду
Механізм: спочатку реакція йде повільно CN- атакує δ-. В результаті взаємодії утворюється аніон, який приєднується;
в) приєднання гідросульфіта натрію (NaHSO3):

утворюються гідросульфітні похідні.
Реакція протікає за механізмом нуклеофільного приєднання (AN);
δ+ – найбільший у першого представника – метаналя;
При введенні алкільного радикалу δ+ гаситься за рахунок +І (позитивного індукційного ефекту). Чим більший радикал, тим більш реакційна здібність зменшується. Ще менша реакційна здібність для кетонів. Реакції приєднання характерні для кетонів, які мають ацетогрупу. Це пов'язано з екрануванням.
Гідросульфітні сполуки – кристалічні речовини. Ця реакція використовується для якісного визначення альдегідів та кетонів; для їх виділення у суміші з іншими сполуками та очистки;
г) приєднання магній-органічних сполук (реактив Гріньяра):

д) приєднання спиртів.
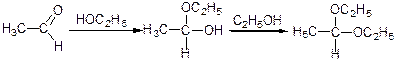
Спочатку утворюється напівацеталь оцтового альдегіду потім – повний ацеталь.
2.
Реакції заміщення:
а) заміщення карбонільного кисню на галоген. При взаємодії альдегідів і кетонів з PCl5 відбувається заміщення карбонільного кисню в їх молекулах на атоми хлору. В результаті утворюються гемін альні дихлоралкани:

б) реакції заміщення кисню на замісники аміновмісних сполук:

в) взаємодія з гідразином:

гідразин гідразон оцтового альдегіду
г) взаємодія з фенілгідразином:
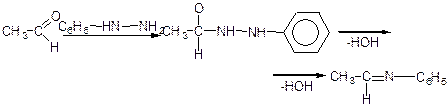
фенілгідразин фенілгідразон оцтового альдегіду
д) взаємодія з гідроксил аміном:

оксим оцтового альдегіду
Ті ж самі реакції дають і кетони, при чому ароматичні кетони більш реакційно здібні, ніж аліфатичні. Це пов'язано з електронно-акцепторним або електронно-донорним впливом функцій ним угрупувань.
Альдегіди більш реакційно здібні, ніж кетони в цих реакціях. Оксими та фенілгідразони – кристалічні речовини з характерними для кожної карбонільної сполуку температурами плавлення. Їх використовують для аналітичної характеристики альдегідів і кетонів, або для виділення альдегіда або кетона із суміші речовин інших класів.
3.
Реакції вуглеводневого радикалу. Карбонільна група також впливає на радикали, з якими вона зв'язана. Це залежить від природи радикалу (аліфатичний, ароматичний, насичений або ненасичений).
В насичених альдегідах або кетонах під впливом карбонільної групи особливу рухливість приймають атоми гідрогену, які знаходяться в α-положеннях.
Внаслідок цього гідроген достатньо легко відходить у вигляді протону. Галогенування альдегідів та кетонів відбувається значно легше, ніж для відповідних вуглеводнів:
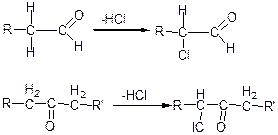
α-галоген
Велику цікавість представляють деякі реакції в лужному середовищі:

Послідовно заміщуються всі гідрогени на галоген та утворюється трихлороцтовий альдегід.
Під дією лугу зв'язок С-С розвивається, утворюється хлороформ і сіль мурашиної кислоти.
Це один із методів отримання хлороформу (СНCl3), бромоформу (CHBr3), йодоформу (СНІ3).
Ненасичені альдегіди та кетони ведуть себе подібно до ненасичених сполук. Для них характерні реакції на етиленовий подвійний зв'язок:
а) знебарвлення бромної води:
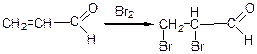
α, β-дібромпропіоновий альдегід
або
1,2-дібромпропіоновий альдегід
Ненасичені альдегіди та кетони, в яких карбонільна група безпосередньо зв'язана з етиленовим зв'язком, називаються α, β-ненасиченими альдегідами та кетонами (акролеїн);
б) взаємодія з гідогенгалегонідами (HHal):

Внаслідок електронних ефектів реакція йде проти правила Марковникова.
Ароматичні альдегіди та кетони.
У випадку ароматичних альдегідів та кетонів реакції в вуглеводневому радикалі – це реакції електрофільного заміщення (SE) в ароматичному ядрі (галогенування, нітрування, сульфування).
В зв'язку з тим, що карбонільна група – орієнтант ІІ роду, орієнтація відбувається по відношенню цієї групи в метаположення: ця реакція йде аналогічно для кетонів;
 метанітробензальдегід
метанітробензальдегід
в) реакції конденсації. Реакціями конденсації називаються реакції ущільнення органічних молекул, які призводять до утворення більш складних сполук в результаті виникнення нових С-С зв'язків. Наприклад, при конденсації оцтового альдегіду під впливом лугів одна молекула альдегіду реагує зі своєю карбонільною групою, а друга – з атомом карбона в α-положенні відносно карбонілу, який містить рухомий атом водню.

Ця реакція називається альдольною конденсацією. Конденсацію двох молекул альдегідів або кетонів, в наслідок якої утворюються альдегідо- або кетоноспирти, називають альдольною конденсацією. Сполука, що утворилася називається альдолем.
Каталізатор даного процесу – луги. Їх роль полягає в утворенні карп-аніону.
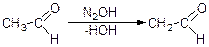

Альдольна конденсація йде за рахунок атома водню тільки в α-положенні до карбонільної групи.
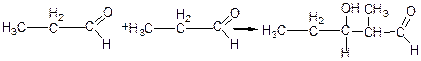
Якщо гідроксильна група (ОН) знаходиться в β-положенні, утворюються нестійкі сполуки; в результаті взаємодії ОН-групи в β-положенні і рухливого атома гідрогену в α-положенні відщеплюються води з утворенням α, β-ненасиченої сполуки.
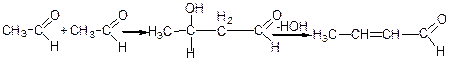
В результаті цієї реакції утворюється ненасичений кротоновий альдегід, а реакція називається кротоновою конденсацією.
У випадку кетонів реакція відбувається аналогічно;
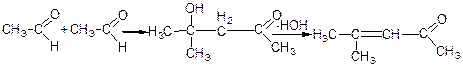
г) утворення фенілформальдегідних смол:
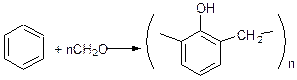
д) реакції полімеризації. Альдегіди містять високореакційноздатний подвійний зв'язок С=О і завдяки його наявності можуть полімеризуватися. Для кетонів реакції полімеризації нехарактерні. Полімеризація альдегідів може бути циклічна і лінійна. В результаті полімеризації мурашиного альдегіду утворюється паро форм (присутність H2SO4 розведеної), а при полімеризації оцтового альдегіду – триоксан (Т=200С, присутність H2SO4 (конц.));

е) реакції окислення. Альдегіди легко окислюються до карбонових кислот з тією ж кількістю атомів карбону. Вони можуть окислюватись киснем повітря, а також достатньо слабкими окислювачами: Cu(OH)2; [Ag(NH3)2]:
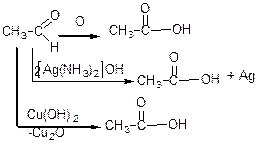
Ці реакції якісні на альдегідну групу, кетони в цій реакції не вступають.
Окиснення кетонів відбувається значно складніше. Вони не окислюються слабкими окислювальними агентами, а тільки під дією КМпО4 або хромової суміші;

є) окисно-відновна реакція Канніццаро (диспропорціювання):
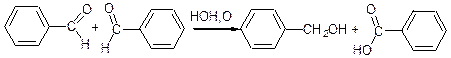
В результаті цієї реакції одна молекула альдегіду відновлюється до спирту, а друга при цьому окислюється до карбонової кислоти.
Читайте також:
- А/. Фізичні особи як суб’єкти цивільного права.
- Аналізатори людини та їхні властивості.
- Аналізатори людини та їхні властивості.
- Будова атомів та хімічний зв’язок між атомами визначають будову сполук, а отже і їх фізичні та хімічні властивості.
- Будова оптоволокна та основні фізичні явища в оптоволокні.
- Векторний добуток і його властивості.
- Відношення еквівалентності та порядку, їх властивості. Впорядковані множини. Зв'язок відношення еквівалентності з розбиттям множини на класи, що попарно не перетинаються.
- ВЛАСНІ ФІЗИЧНІ ПОЛЯ ОРГАНІЗМУ ЛЮДИНИ
- Властивості.
- Геометричні й фізичні застосування кратних інтегралів.
- Геофізичні явища зумовлені обертанням Землі навколо осі
- Дебітори –це юридичні та фізичні особи, які внаслідок минулих подій, заборгували підприємству певні суми грошових коштів, їх еквівалентів та інших активів.
| <== попередня сторінка | | | наступна сторінка ==> |
| Опис протоколу HTTP. | | | Конфеденційність, доступність та цілісність інформації. |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |