
МАРК РЕГНЕРУС ДОСЛІДЖЕННЯ: Наскільки відрізняються діти, які виросли в одностатевих союзах
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
Контакти
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Водневий показник
При кімнатній температурі (22°С) нейтральні розчини мають однакову концентрацію: [Н+] = [ОН-]1 = 10-7 моль/л і К(Н2О) = 10-14. Таке саме значення Кн,о мають при цій температурі і водні розчини кислот і основ. Тому, якою б великою не була концентрація йонів водню, концентрація гідро ксид-йонів не матиме нульового значення або навпаки. Це дає змогу обчислювати концентрацію [Н+] або [ОН-], якщо одна з цих величин відома:

Наприклад, концентрація йонів водню у 5•10-3 М розчині гідроксиду натрію дорівнюватиме:
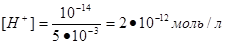
Проте записувати концентрації іонів Н+ або ОН- через від’ємний степінь не зовсім зручно. Ось чому кислотні властивості розчинів датський біохімік Серенсен (1909 р.) запропонував характеризувати величиною водневого показника рН, який визначається за співвідношенням
рН = -lg[H+].
Оскільки концентрація йонів водню може змінюватись у межах йонного добутку, то рН змінюється в інтервалі від нуля до чотирнадцяти.
У нейтральному розчині [Н+] = 10-7 моль/л; рН = -lg[H+] = 10-7 = 7. У кислому розчині [Н+] > 10-7 моль/л; рН < 7. Так, для 10-3М розчину НС1 [Н+]= 10-3 моль/л; рН = 3. Для розчину КОН такої самої концентрації
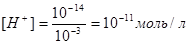
і рН = 11. Отже, нейтральний розчин рН = 7, кислий рН<7 лужний рН>7. Розчини, значення рН яких перебуває в інтервалі від 0 до 3, належать до сильнокислих; при рН = 4...6 — слабкокисле середовище. Слабколужні розчини мають рН = 8... 10, а сильнолужні —рН= 11...14.
Розчини, в яких [Н+] >1 моль/л, мають від’ємне значення рН. Так, якщо [Н ‘•‘І = 2, то рН = -0,3.
Читайте також:
- IV група- показники надійності підприємства
- Абсолютні показники фінансової стійкості
- Абсолютні показники фінансової стійкості та її типи
- Абсолютні та відності показники результатів діяльності підприємства.
- Аналіз відносних показників прибутковості (рентабельності) роботи банку
- Аналіз макроекономічних показників
- Аналіз основних техніко-економічних показників діяльності підприємств будіндустрії
- Аналіз показників валового прибутку і собівартості реалізованої продукції
- Аналіз показників прибутковості та рентабельності підприємства
- Аналіз показників рентабельності.
- Аналіз показників складу, структури й технічного стану основних фондів.
- Аналіз ризикованості підприємства на основі показників фінансового стану.
| <== попередня сторінка | | | наступна сторінка ==> |
| Дисоціація води. Йонний добуток води | | | КЛАСИФІКАЦІЯ ЗАДАЧ ОРГАНІЗАЦІЙНОГО УПРАВЛІННЯ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |