
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
Електропровідність розчинів електролітів характеризує його здатність проводити електричний струм.
Вона є величиною, оберненою електричному опору. В свою чергу опір R залежить від довжини провідника L, площі поперечного перерізу S і питомого опору ρ:
R = р 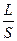 ; р =
; р = 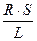
Розрізняють питому і еквівалентну електропровідність розчинів електролітів.
Питома електропровідність – електропровідність розчину електроліту, що міститься між двома електродами площею по 1см2 кожний, розташованими на відстані 1см один від одного.
Питома електропровідність χ– це величина, обернена питомому опору ρ:
χ =  =
= 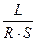
Питома електропровідність χ вимірюється:
[ χ ] = 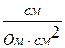 =
=  = См/см
= См/см 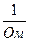 = См (Сіменс)
= См (Сіменс)
 Зі збільшенням концентрації електроліту, а, отже, і концентрації іонів, питома електропровідність зростає до деякої межі. При досить великій концентрації зменшуєтьсяступінь дисоціації (в розчинах слабких електролітів) або зростає вплив взаємного притягання іонів ( в розчинах сильних електролітів), що приводить до зменшенняелектропровідності. Особливо виразно такий характер цієї залежності проявляється для розчинів сильних електролітів.
Зі збільшенням концентрації електроліту, а, отже, і концентрації іонів, питома електропровідність зростає до деякої межі. При досить великій концентрації зменшуєтьсяступінь дисоціації (в розчинах слабких електролітів) або зростає вплив взаємного притягання іонів ( в розчинах сильних електролітів), що приводить до зменшенняелектропровідності. Особливо виразно такий характер цієї залежності проявляється для розчинів сильних електролітів.
Рис. 11. Залежність питомої електропровідності розчинів від їх концентрації.
 Залежність питомої електропровідності від температури досить складна, бо визначається багатьма параметрами: в'язкістю середовища, ступенем дисоціації електроліту, гідратацією його іонів, швидкістю їх руху та ін. Найчастіше при збільшенні температури на один градус електрична провідність зростає приблизно на 2%. Це зумовлює необхідність термостатувати розчин при точних вимірюваннях.
Залежність питомої електропровідності від температури досить складна, бо визначається багатьма параметрами: в'язкістю середовища, ступенем дисоціації електроліту, гідратацією його іонів, швидкістю їх руху та ін. Найчастіше при збільшенні температури на один градус електрична провідність зростає приблизно на 2%. Це зумовлює необхідність термостатувати розчин при точних вимірюваннях.
Рис. 12. Співвідношення між питомою та молярною електропровідністю.
Таким чином, питома електропровідність – це функція багатьох чинників. Визначивши цю величину експериментально, ми, проте, не маємо можливості зробити певні висновки про фізико-хімічні властивості даного розчину електроліту. Тому для зручності врахування впливу концентрації на провідність електролітів Е.Х.Ленц увів поняття про еквівалентну (молярну) електропровідність.
Для характеристики електричної провідності розчинів електролітів частіше використовують еквівалентну електропровідність.
Еквівалентна електропровідність λ – це електропровідність об’єму розчину, в якому міститься 1 моль еквівалента розчиненої речовини і який помістили між електродами, відстань між якими дорівнює 1 см.
На рис.12 видно, що “робоча” площа електродів визначається об’ємом розчину. Одиниця еквівалентної електропровідності.
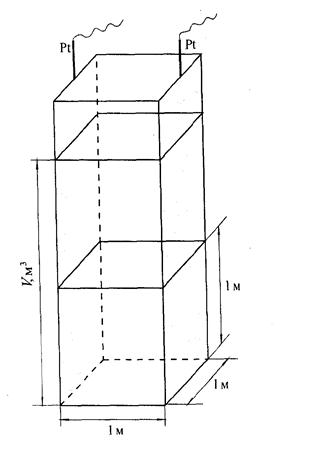
[ λ ] = 
У системі СІ термін «еквівалентна електропровідність» замінено намолярну.Між еквівалентною і питомою електропровідністю існує наступна залежність:
λ = 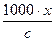 ,
,
де с – еквівалентна концентрація розчину електроліту, що виражається в 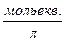
Еквівалентна провідність при розведенні розчину (зменшенні концентрації) збільшується, досягаючи при досить великому розбавленні максимального і постійного значення (рис. 13).
Це граничне значення молярної провідності називають молярною електропровідністю при нескінченному розбавленні і позначають λ∞.

Рис.13. Залежність молярної електропровідності деяких електролітів від розбавлення розчинів.
З рис.13 бачимо, що навіть у дуже концентрованих розчинах сильних електролітів (кислоти, луги, солі) молярна електропровідність досить висока. У сильних електролітах всі молекули дисоційовані. Проте при зменшенні концентрації розчинів спостерігається помітне зростання електропровідності в основному за рахунок послаблення між іонної взаємодії. У концентрованих розчинах слабких електролітів ступінь дисоціації, а отже, й молярна електропровідність дуже незначні. Зі зменшенням концентрації розчину ступінь дисоціації електроліту збільшується, що зумовлює зростання молярної електропровідності, яка прямує до граничного значення λ∞ для нескінченно розбавленого розчину.
Таблиця 1.7
Читайте також:
- V здатність до встановлення та підтримки гарних особистих стосунків і веденню етичного способу життя.
- Абсолютний фагоцитоз або елімінуюча здатність крові (ЕЗК) — це кількість фагоцитованих мікробних клітин лейкоцитами 1 мкл крові.
- Агрегативна стійкість і коагуляція колоїдних розчинів
- Адсорбція електролітів
- Адсорбція електролітів
- АДСОРБЦІЯ З БАГАТОКОМПОНЕНТНИХ РОЗЧИНІВ
- АЧТ-це тіло, поглинальна здатність якого (для всіх довжин хвиль) тотожне 1.
- Бистрість – це здатність людини до термінового реагування на подразники та до високої швидкості рухів, що виконуються при відсутності значного зовнішнього опору.
- Будова та реакційна здатність
- Будь яка передача характеризується передаваємою потужністю та передаточним відношенням.
- В електронагрівачах використано одну з головних властивостей електричного струму - здатність нагрівати провідники.
- Валентність — це здатність атомів одного елемента сполучатися з певним числом атомів інших елементів під час утворення хімічних сполук.
| <== попередня сторінка | | | наступна сторінка ==> |
| Закономірності взаємних перетворень хімічної та електричної форм енергії. | | |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |