
РЕЗОЛЮЦІЯ: Громадського обговорення навчальної програми статевого виховання
ЧОМУ ФОНД ОЛЕНИ ПІНЧУК І МОЗ УКРАЇНИ ПРОПАГУЮТЬ "СЕКСУАЛЬНІ УРОКИ"
ЕКЗИСТЕНЦІЙНО-ПСИХОЛОГІЧНІ ОСНОВИ ПОРУШЕННЯ СТАТЕВОЇ ІДЕНТИЧНОСТІ ПІДЛІТКІВ
Батьківський, громадянський рух в Україні закликає МОН зупинити тотальну сексуалізацію дітей і підлітків
Відкрите звернення Міністру освіти й науки України - Гриневич Лілії Михайлівні
Представництво українського жіноцтва в ООН: низький рівень культури спілкування в соціальних мережах
Гендерна антидискримінаційна експертиза може зробити нас моральними рабами
ЛІВИЙ МАРКСИЗМ У НОВИХ ПІДРУЧНИКАХ ДЛЯ ШКОЛЯРІВ
ВІДКРИТА ЗАЯВА на підтримку позиції Ганни Турчинової та права кожної людини на свободу думки, світогляду та вираження поглядів
- Гідрологія і Гідрометрія
- Господарське право
- Економіка будівництва
- Економіка природокористування
- Економічна теорія
- Земельне право
- Історія України
- Кримінально виконавче право
- Медична радіологія
- Методи аналізу
- Міжнародне приватне право
- Міжнародний маркетинг
- Основи екології
- Предмет Політологія
- Соціальне страхування
- Технічні засоби організації дорожнього руху
- Товарознавство продовольчих товарів
Тлумачний словник
Авто
Автоматизація
Архітектура
Астрономія
Аудит
Біологія
Будівництво
Бухгалтерія
Винахідництво
Виробництво
Військова справа
Генетика
Географія
Геологія
Господарство
Держава
Дім
Екологія
Економетрика
Економіка
Електроніка
Журналістика та ЗМІ
Зв'язок
Іноземні мови
Інформатика
Історія
Комп'ютери
Креслення
Кулінарія
Культура
Лексикологія
Література
Логіка
Маркетинг
Математика
Машинобудування
Медицина
Менеджмент
Метали і Зварювання
Механіка
Мистецтво
Музика
Населення
Освіта
Охорона безпеки життя
Охорона Праці
Педагогіка
Політика
Право
Програмування
Промисловість
Психологія
Радіо
Регилия
Соціологія
Спорт
Стандартизація
Технології
Торгівля
Туризм
Фізика
Фізіологія
Філософія
Фінанси
Хімія
Юриспунденкция
СКЛАДНІ РЕАКЦІЇ. ЛАНЦЮГОВІ РЕАКЦІЇ
Більшість реальних хімічних процесів представляє собою сукупність декількох простих хімічних реакцій, пов’язаних між собою. До таких складних реакцій належать паралельні, зворотні, послідовні і спряжені реакції. Такі реакції проходять через низку простих послідовних, а іноді паралельних реакцій, які називаються елементарними. Сукупність елементарних стадій, через які здійснюється перетворення початкових речовин у продукти реакції, тобто шлях, через який проходить реакція, називається механізмом реакції. Ці елементарні стадії можуть бути зворотними чи незворотними.
Паралельними реакціями називають такі реакції, в яких одні й ті самі вихідні речовини, реагуючи одночасно, утворюють різні продукти.
Схематично паралельні реакції можна представити рівнянням:
 К1 В
К1 В
 А К1 B або 2А→
А К1 B або 2А→

 А К2 C К2 C
А К2 C К2 C
Прикладом такої реакції може служити розкладання при нагріванні бертолетової солі ( КСlО3), яке може йти в двох направленнях:

 2КСlО3 К 1 2КСl + 3О2 і 4 КСlО3 К2 3КСlО4 + КCl
2КСlО3 К 1 2КСl + 3О2 і 4 КСlО3 К2 3КСlО4 + КCl
На відміну від кінетичних рівнянь простих реакцій кінетичне рівняння паралельних реакцій включає кілька констант швидкостей.
До зворотних реакційвідносяться такі, які йдуть як в прямому, так і в зворотному напрямках.
В загальному вигляді це рівняння записують так:
К1

 А B
А B
К2
Швидкість такої реакції дорівнює різниці швидкостей прямої ύ1 , і зворотної ύ2 реакцій ύ = ύ1 – ύ2. наприклад, сахароза, взаємодіючи за певних умов з водою, дає глюкозу і фруктозу. Водночас глюкоза і фруктоза, відщеплюючи воду, перетворюється в сахарозу:

 Н2О + С12Н22О11 С6Н12О6 + С6Н12О6
Н2О + С12Н22О11 С6Н12О6 + С6Н12О6
сахароза глюкоза фруктоза
Швидкість прямої реакції з часом зменшується, швидкість зворотної реакції збільшується. При досягненні рівності цих швидкостей (ύ1 – ύ2 ) настає стан рівноваги.
Послідовні реакції проходять в декілька реакцій - проміжних стадій, що йдуть одна за одною:


 А К1 В К2 С К3 Д...
А К1 В К2 С К3 Д...
Кожна з цих стадій являє собою моно- або бімолекулярну реакцію, в результаті якої утворюються проміжні речовини. До послідовних реакцій відносяться, наприклад, гідроліз ефірів і полісахаридів, термічний крекінг вуглеводів.
Швидкість послідовних реакцій визначається найбільш повільною стадією.
Спряженими реакціями називають реакції виду:
 А + В М
А + В М
 А + С N
А + С N
Характерною особливістю спряжених реакцій є те, що якщо перша реакція може йти самостійно, то друга йде тільки сумісно з першою.
Без першої реакції не йде й друга.
Так, наприклад, йодоводнева кислота не окислюється таким сильним окисником, як пероксид водню. Але разом з сульфатом феруму (ІІ), який легко окислюється пероксидом водню, буде окислюватися й йодоводнева кислота. Таким чином, реакція окислення FeSO4 індукує витіснення йодоводневої кислоти. Загальною речовиною А для обох розглянутих реакцій є пероксид водню (актор), сульфат феруму (речовина В) служить індуктором, а НІ - акцептором.
Ланцюгові реакції
Багато хімічних реакцій відбуваються через проміжні стадії, в яких беруть участь активні частинки – вільні радикали і атоми. Якщо ці активні частинки регенеруються протягом реакції, то це забезпечує її високу швидкість. Такі процеси називаються ланцюговими.
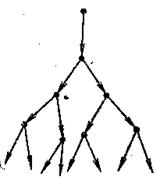 Ланцюгові реакції дуже поширені і мають велике практичне значення. Велику роль у створенні і розробці теорії ланцюгових процесів відіграли праці радянського вченого, лауреата Нобелівської премії академіка М.М.Семенова та його учнів.
Ланцюгові реакції дуже поширені і мають велике практичне значення. Велику роль у створенні і розробці теорії ланцюгових процесів відіграли праці радянського вченого, лауреата Нобелівської премії академіка М.М.Семенова та його учнів.
Рис. 17. Схема лавиноподібного розвитку розгалуженої ланцюгової реакції
Розрізняють ланцюгові процеси з розгалуженими (рис.17) і нерозгалуженими ланцюгами.
Кожний ланцюговий процес починається з утворення вільного радикала або атома – активних частинок, які, на відміну від молекул, мають ненасичені валентності. Такі активні частинки утворюються під дією якогось джерела енергії.
Потім відбувається взаємодія вільного радикала або атома з молекулами. Внаслідок цього в молекулі розривається валентний зв’язок і утворюється новий радикал або атом, який знову реагує з молекулами. Багаторазове повторення таких реакцій і утворює ланцюг.
Ланцюговими реакціями з нерозгалуженим ланцюгом називають реакції, під час яких при взаємодії однієї активної частинки щоразу утворюється лише одна нова активна частинка і кількість їх при розвитку ланцюга не збільшується.
Ланцюговими реакціями з розгалуженими ланцюгами називають реакції, під час яких внаслідок взаємодії активної частинки утворюються дві активні частинки або більше, та кількість їх швидко збільшується, і відповідно зростає швидкість хімічної реакції.
Розглянемо ланцюгову реакцію з нерозгалуженим ланцюгом — реакцію взаємодії водню з хлором. Ці реакції практично не проходять в темряві, бо для утворення НСl з Н2 і Сl2, потрібна велика енергія активації. Якщо суміш водню і хлору опромінити видимим світлом або потоком радіоактивних частинок, то утворюються атоми хлору:
С12 + hv → 2Сl•
Після цього починає розвиватись ланцюг:
Cl• + H2 → HCl + H•,
H• + Cl2 → HCl + Cl•,
Cl• + H2 → HCl + H• і т. д.
Як видно з наведених реакцій, одна активна частинка при взаємодії зникає і утворює лише одну нову активну частинку (атом Гідрогену або Хлору). Отже, число активних частинок не збільшується. Якщо опромінення швидко припинити, то кількість активних частинок навіть зменшуватиметься внаслідок реакцій рекомбінації вільних радикалів у молекулу:
Н• + •Сl →НСl,
Н• + •Н → Н2,
Сl• + •Сl → Сl2.
Зазначені реакції призводять до обриву ланцюга; вільні атоми (атом-радикали) зникають, а нові активні частинки не утворюються.
Зауважимо, що ймовірність реакцій рекомбінації значно менша, ніж реакцій основного ланцюга, тому що концентрація молекул водню і хлору в системі на кілька порядків більша, ніж концентрація атомів. Ймовірність зіткнення атомів Н• з молекулами Сl2 (або Сl• з Н2) значно більша, ніж імовірність зіткнення атомів між собою.
Крім того, з'єднання двох однакових атом-радикалів, наприклад атомів водню, в молекулу можливе лише в тому разі, коли в момент зіткнення атоми віддають надлишок енергії якому-небудь тілу.
Отже, при ланцюгових реакціях з нерозгалуженим ланцюгом кількість активних частинок не тільки не збільшується при розвитку ланцюга, а навіть може частково зменшуватись внаслідок рекомбінації атомів-радикалів і обриву ланцюга. Водночас такі ланцюгові реакції можуть призвести до вибуху. Так, якщо суміш хлору з воднем при їх досить великій концентрації на короткий час освітити, то відбудеться реакція з вибухом. Вибух у цій реакції має тепловий характер.
Тепловий вибух буде тоді, коли швидкість виділення тепла при проходженні реакції значно перевищує швидкість віддачі системою тепла зовнішньому середовищу. Внаслідок цього температура реакційної суміші швидко підвищується, відповідно швидко зростає і швидкість реакції.
Отже, підвищення температури автокаталітично прискорює реакцію, внаслідок чого станеться вибух.
Взагалі для будь-якої реакційної суміші (якщо реакція екзотермічна) при досить високій концентрації реагентів швидкість виділення тепла перевищує швидкість його віддачі. Такі системи завжди вибухають. Для посудини певного розміру з певною початковою температурою існує гранична концентрація реагентів, вище якої станеться вибух. Усе це докладно описав М. М. Семенов.
У газових системах тепло, яке виділяється під час реакції, надходить лише в зовнішнє середовище. У розчинах тепло, яке виділяється при реакції, значною мірою поглинається розчинником, який безпосередньо не бере участі в реакції. Все це знижує можливість різкого підвищення температури розчину. Крім того, підвищенню температури перешкоджає ендотермічний процес фазового переходу рідини в газ.
При ланцюгових реакціях з розгалуженим ланцюгом прогресивно і швидко зростає концентрація активних частинок, що призводить до катастрофічного зростання швидкості реакції і до вибуху. Таким чином, основним автокаталітичним фактором тут є збільшення кількості активних частинок. Характерною реакцією цього типу є реакція водню з киснем, яку докладно вивчив академік В. М. Кондратьєв. Внаслідок безпосередньої взаємодії молекул О2 і Н2утворюються радикали •ОН, Н• і НО2:
Н2 + О2 = 2•ОН; Н2 + О2 = Н• + НО2.
Ці реакції відбуваються повільно. Але потім починаються швидкі процеси з участю радикалів:
•ОН + Н2 = Н2О + Н•,
Н• + О2= •ОН + О•,
О• + Н2 = •ОН + Н•.
Як видно з двох останніх рівнянь, одна активна частинка—атом-радикал Н• приводить до появи трьох нових активних частинок: двох частинок ОН• і одного атом-радикала Н•. Внаслідок цього в реакційній суміші з величезною швидкістю зростає число активних частинок.
З участю вільних радикалів відбуваються різноманітні хімічні процеси — реакції окислення вуглеводнів, реакції полімеризації та ін.
Вільні радикали можуть утворюватись під дією ультрафіолетових і рентгенівських променів, γ-променів, під дією нейтронів або ά-частинок, які спричинюють розрив хімічного зв'язку.
З появою вільних радикалів у клітинах живих організмів пов'язана променева хвороба. Вільні радикали, які утворюються внаслідок радіоактивного опромінення (головним чином, радикал •ОН), спричинюють ланцюговий процес у клітинах, в який втягуються ферменти, білки та інші складові частини клітини.
4. ФОТОХІМІЧНІ РЕАКЦІЇ
Реакції, що протікають під дією світла, називають фотохімічними.
До фотохімічних процесів відноситься велика кількість різних реакцій. Наприклад, на світлові суміш газів Н2 і F2 зривається; аміак розкладається на N2 і Н2 і під дією ультрафіолетового випромінювання утворюється озон з молекулярного кисню. Фотохімічні реакції лежать в основі фотографічних процесів, відбілюючої дії кисневмісних сполук хлору.
Під дією ультрафіолетового випромінювання сонячного світла в шкірі людини синтезується необхідний вітамін Д, що має антирахітичну активність. Синтетичний вітамін Д одержують в промисловості, також використовуючи фотохімічну реакцію.
Під дією світла може змінюватися якість харчових продуктів. наприклад, молоко втрачає вітаміни, набуває неприємного смаку.
Найважливішим фотохімічним процесом є протікання в зелених рослинах процесу фотосинтезу – утворення вуглеводів та інших органічних сполук з СО2 і Н2О під дією енергії сонячного світла, що поглинається зеленим пігментом рослин - хлорофілом:
 6СО2 + 6Н2О С6 Н12О6 + 6О2
6СО2 + 6Н2О С6 Н12О6 + 6О2
Цей процес складний, складається з ряду стадій, багато з яких до цих пір вивчені недостатньо.
Фотосинтез – найважливіший біохімічний процес на Землі, бо це єдине джерело поповнення запасів атмосферного кисню і органічних речовин, які служать їжею для людей і тварин. Основоположником вчення про фотосинтез був російський фізіолог К.А.Тимирязєв.
Фотохімічна дія світла полягає в тому, що атоми і молекули реагуючих речовин, поглинаючи світлові кванти - фотони, збуджуються.
Енергія фотону Е зв’язана з частотою його випромінювання ν співвідношенням:
Е = h ·ν, де
h – постійна Планка, h = 6,626 · 10 –34 Дж/Гц або (Дж ·с).
З цієї формули витікає, що більшу енергію і високу хімічну активність мають світлові промені з більшою частотою, тобто з меншою довжиною хвилі. Найбільш активними є фіолетові промені, найменш активною є червона частина спектра.
При поглинанні світла молекулами речовини посилюється коливальний рух атомів і атомних груп, послаблюється зв’язок між ними, тобто молекули переходять в активний, збуджений стан. У деяких випадках енергія фотону достатня для розриву внутрішньомолекулярних зв’язків.
Між кількістю поглинутої енергії при фотохімічній реакції і кількістю речовини, що прореагувала існує залежність, яка виражається законом фотохімічної еквівалентності Ейнштейна (1912) р.
За цим законом кожна молекула, що реагує під дією світла, поглинає один квант випромінювання, який викликає реакцію.
Експериментальна перевірка закону фотохімічної еквівалентності показала, що іноді числомолекул, якіпрореагували, не дорівнюєчислупоглинутихквантів. Тому для кінетичної характеристики фотохімічних реакцій введено поняття квантового виходу.
Квантовим виходом фотохімічної реакції æ називається відношення числа молекул N, що прореагували, до числа поглинутих квантів світла n:
N
 æ = n
æ = n
За законом фотохімічної еквівалентності квантовий вихід повинен дорівнювати 1, але зустрічаються реакції, у яких він або більше 1, або менше 1.
Відхилення від закону фотохімічної еквівалентності пов’язані з різними вторинними процесами. Так æ < 1 спостерігається в тих випадках, коли частина фотонів поглинається молекулами сторонніх речовин, що знаходяться в суміші з реагуючими речовинами.
æ > 1 може бути обумовлений тим, що перетворення, визвані поглинанням молекулою кванту світла, приводять до утворення активних частинок, які вступають у вторинні “теплові” реакції. Наприклад, при
фотохімічному розкладанні бромоводню первинний процес зводиться до дисоціації його на атоми:
 НВr hν Н∙ + Вr∙
НВr hν Н∙ + Вr∙
Потім ідуть вторинні реакції:

 НВr + Н∙ Н2 + Вr; Вr∙ + Вr∙ Вr2
НВr + Н∙ Н2 + Вr; Вr∙ + Вr∙ Вr2
Загальна схема процесу:
 2НВr hν Н2 + Вr2 ; æ =2
2НВr hν Н2 + Вr2 ; æ =2
Таким чином, відхилення від закону фотохімічної еквівалентності викликаються вторинними процесами.
Первинні ж перетворення, безпосередньо пов’язані з поглинанням світла, добре описується законом Ейнштейна.
Читайте також:
- VIII. Реакції, в результаті яких утворюються високомолекулярні сполуки
- АДАПТАЦІЙНІ РЕАКЦІЇ М'ЯЗОВОЇ СИСТЕМИ
- АДАПТИВНІ РЕАКЦІЇ МІКРООРГАНІЗМІВ НА СТРЕСОВІ ДІЇ.
- Аналітичні реакції (реактиви)
- Аналітичні реакції та вимоги, яким вони повинні відповідати.
- Антиген - це полімер органічної природи, генетично чужерідний для макроорганізма, при потраплянні в який викликає імунні реакції, що направлені на його видалення.
- Антигени. Антитіла. Серологічні реакції .
- Базисні і ланцюгові індекси.
- БЕЗСПОЛУЧНИКОВІ СКЛАДНІ РЕЧЕННЯ З ОДНОРІДНИМИ І НЕОДНОРІДНИМИ ЧАСТИНАМИ
- Біогенні аміни та реакції декарбоксилювання
- Бухгалтерські записи (проводки) – прості та складні.
- Види опор та їх реакції
| <== попередня сторінка | | | наступна сторінка ==> |
| ЗАЛЕЖНІСТЬ ШВИДКОСТІ РЕАКЦІЇ ВІД ТЕМПЕРАТУРИ | | | КАТАЛІЗ І КАТАЛІЗАТОРИ |
|
Не знайшли потрібну інформацію? Скористайтесь пошуком google: |
© studopedia.com.ua При використанні або копіюванні матеріалів пряме посилання на сайт обов'язкове. |